“Omnia venenum sunt: nec sine veneno quicquam existit. Dosis sola facit, ut venenum non fit.” “Tutto è veleno, e nulla esiste senza veleno. Solo la dose fa in modo che il veleno non faccia effetto” (Paracelso)
Un proverbio calabrese recita così: “cu mori pi fungi, fissa a cù ciangi” e noi sappiamo che c’è sempre del vero nei proverbi della nostra terra. Per questo si parlerà in questa pagina di tossicologia. La tossicologia può essere definita come la scienza che studia le interazioni tra le sostanze tossiche, prodotte dal metabolismo secondario dei funghi, ed i sistemi biologici al fine di determinare i possibili effetti sugli organismi viventi e di comprendere la natura, l’incidenza, il meccanismo d’azione e la reversibilità di tali effetti, valutando quantitativamente le alterazioni biologiche indotte.
Funghi, digeribilità, tossine termolabili e false intossicazioni
Tutti noi pensiamo che i casi di intossicazione da funghi siano sempre o quasi legati all’ingestione di funghi velenosi. Invece la maggior parte dei ricoveri per intossicazione da funghi avviene per ingestione di funghi considerati eduli. Molti dei ricoveri al pronto soccorso infatti raccontano di gente che ha consumato porcini, leccini, chiodini, bavose (luteus, collinitus, granulatus bellinii o mediterranensis) o mazze di tamburo.
Innanzitutto bisogna ricordare che tutti i funghi, anche quelli eduli contengono sostanze (chitina) difficilmente attaccabili dai succhi gastrici, per cui sono poco digeribili già in quantità moderata, soprattutto dai bambini. La chitina è un polisaccaride azotato che costituisce, per esempio, l’esoscheletro degli insetti o il carapace dei crostacei ed è presente nei funghi. È noto infatti che è difficile da digerire, per esempio, la scorza dei gamberi.
Quindi bisogna consumare funghi eduli in modica quantità che, secondo alcuni autori, corrisponde a circa 5 grammi per Kg di peso corporeo a settimana, mentre altri autori considerano un massimo di 350 grammi di funghi a settimana (il Ministero della Salute tedesco consiglia di non superare i 200 grammi).
Poi bisogna considerare anche la facile deperibilità dei funghi che, raccolti già vecchi, tenuti in condizioni di poca aria (sacchetti di plastica), in temperature elevate (come il cofano dell’automobile) o congelati da crudi per lunghi periodi, possono causare delle gastroenteriti anche se sono funghi normalmente eduli, perfino da crudi.
Anche la pratica di consumare funghi crudi, quei pochi che possono essere consumati senza cottura, deve diventare una rara evenienza e solo per funghi giovani e consumati in meno di una giornata.
Passiamo ora a considerare le specie di funghi commestibili che hanno tossine termolabili.
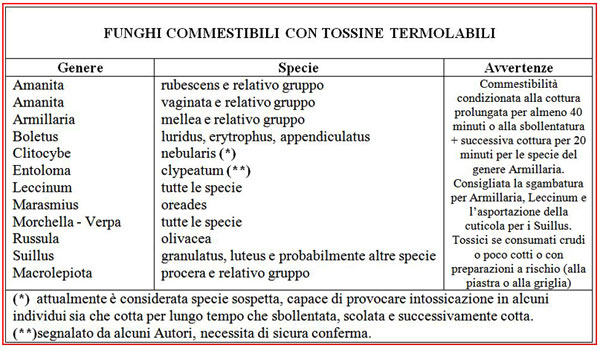 Nella tabella sono presenti quasi tutti i funghi di questo gruppo e le avvertenze per la cottura. Sfogliando sempre i casi di ricovero viene confermato che, per questi tipi di funghi, non viene rispettato il tempo di cottura che, secondo i più autorevoli studiosi, deve essere di almeno 35/45 minuti. I casi infatti di ricovero per l’ingestione di funghi con tossine termolabili dimostrano, nella maggior parte delle volte, che sono stati assunti dopo averli “cotti” alla griglia o fritti per tempi che non consentono alla cottura di arrivare al cuore del fungo. Non fidarsi mai, quindi, degli amici che dicono “bastano 5 minuti”!
Nella tabella sono presenti quasi tutti i funghi di questo gruppo e le avvertenze per la cottura. Sfogliando sempre i casi di ricovero viene confermato che, per questi tipi di funghi, non viene rispettato il tempo di cottura che, secondo i più autorevoli studiosi, deve essere di almeno 35/45 minuti. I casi infatti di ricovero per l’ingestione di funghi con tossine termolabili dimostrano, nella maggior parte delle volte, che sono stati assunti dopo averli “cotti” alla griglia o fritti per tempi che non consentono alla cottura di arrivare al cuore del fungo. Non fidarsi mai, quindi, degli amici che dicono “bastano 5 minuti”!
Infine ricordate tre massime importanti:
Fatevi controllare i funghi non dai cosiddetti “esperti fungaioli” che sentenziano facilmente ma non firmano niente, ma dall’ispettorato micologico dell’ASL.
Non regalate mai i funghi a nessuno! I funghi non si regalano!
Fungus, qualiscumque sit, sempre malignus est! ( il fungo, qualunque esso sia, è sempre velenoso)
Intossicazioni vere e false

“cu mori pi fungi fissa cu u ciangi”
recita così un detto Reggino che evidenzia quanto sia inutile piangere chi mette nel proprio piatto funghi tossici o peggio ancora velenosi mortali.
Iniziamo oggi un percorso che ci porterà a conoscere la micotossicologia. L’argomento è abbastanza vasto per cui sarà diviso in capitoli. Abbiamo cercato di essere semplici nel linguaggio ma, trattandosi di materia alquanto difficile, siamo costretti ad usare , quando occorre, termini prettamente scientifici.
Prima di affrontare in maniera esaustiva il capitolo delle intossicazioni da funghi è opportuno fare una considerazione che, a mio avviso, ci sarà estremamente utile per focalizzare meglio questo argomento e cioè: le reazioni avverse al consumo di funghi solitamente vengono distinte in:
• tossiche, o vere;
• non tossiche o false.
Quelle vere, chiamate più propriamente micetismi, colpiscono indistintamente tutti gli individui.
Le false, invece, dipendono dalla risposta individuale di ciascun soggetto.
Le intossicazioni vere sono pertanto legate al consumo di entità fungine che contengono una o più sostanze tossiche, prodotte dal metabolismo secondario dei funghi, in grado di esercitare un’azione venefica a livello dei vari organi ed apparati (fegato, reni, apparato digerente, sistema nervoso centrale, apparato cardiocircolatorio, ecc.).
Considerato che, nella maggior parte delle intossicazioni, la sintomatologia iniziale è spesso caratterizzata da disturbi a carico del tratto gastroenterico, come: nausea, vomito, dolori addominali e diarrea, assume particolare importanza, dal punto di vista prognostico, il tempo che intercorre tra l’ingestione del pasto fungino e la comparsa del corredo sintomatologico: pur con estrema cautela, la latenza può essere utile per distinguere gli avvelenamenti da tossine citolitiche da quelle cosiddette “funzionali” ovvero non accompagnate da danno epatico e/o renale. Un periodo di latenza non superiore alle 4-6 ore si risolve nel giro di qualche giorno per mezzo di terapie specifiche, senza lasciare reliquati importanti; quando la latenza va dalle 6 alle 12 ore ed oltre, si deve sospettare una grave intossicazione con danno d’organo, spesso mortale!
Riteniamo importante mettere in guardia il raccoglitore comune sulla reale pericolosità legata all’uso alimentare dei funghi, spesso ignorata da false credenze (annerimento dell’aglio, di oggetti d’argento, ecc.), prive di qualsiasi fondamento scientifico, che possono risolversi talvolta con tragiche conseguenze. Potrà sembrare strano ma queste convinzioni, ancora radicate, provocano ogni anno molte intossicazioni che potrebbero essere tranquillamente evitate facendo controllare i funghi raccolti presso gli Ispettorati Micologici delle ASL (il servizio è gratuito), o da esperti qualificati delle Associazioni Micologiche. L’unico modo per poter dire se un particolare fungo è commestibile è quello di identificare correttamente la specie.
Incominciamo quindi ad esaminare, una per una, le false intossicazioni:
Intolleranze:
• subito dopo aver consumato un’insalata di porcini “crudi”, possono manifestarsi sintomi gastroenterici. In questo caso non si tratta di una vera intossicazione legata a particolari tossine, ma a fenomeni di intolleranza che colpiscono solamente gli individui geneticamente predisposti, più precisamente tutti quei soggetti che presentano una carenza dell’enzima trealasi. Il fungo, ed in particolare il Boletus edulis, soprattutto quando è giovane, risulta molto ricco in trealosio, un disaccaride costituito da due molecole di glucosio; quando il contenuto in trealosio è elevato e il fungo viene mangiato crudo, possono verificarsi, dopo l’ingestione, severe intolleranze alimentari, caratterizzate da disturbi gastrointestinali dovute a fermentazione, nel lume intestinale, dello zucchero non metabolizzato.
• Altri funghi come Boletus aestivalis, Agaricus spp., Lactarius spp., sono ricchi in mannitolo, uno zucchero semplice dotato di potere lassativo: infatti, per effetto osmotico, è in grado di richiamare acqua nell’intestino, determinando, se consumato crudo, la cosiddetta “diarrea osmotica”.
È sconsigliata, l’assunzione di funghi crudi ( es. insalata di porcini) se questa non avviene entro 24 h dopo la raccolta. Ricordiamo inoltre di non conservare i funghi crudi in congelatore per più di un anno.
Per evitare queste intolleranze è sufficiente non consumare funghi crudi.
Tossinfezioni:
• nei funghi crudi è possibile rilevare la presenza di numerose colonie batteriche potenzialmente patogene. Capita quindi che alcune sindromi gastrointestinali, che si verificano in seguito al consumo di funghi, siano in realtà riconducibili a contaminazioni batteriche presenti sul fungo stesso, soprattutto se mal conservato (la conservazione prolungata, a temperatura ambiente, favorisce la replicazione batterica), o poco cotto, rappresenta una sicura fonte di pericolo. In questo caso la sintomatologia insorge, in base al tipo di microrganismo colonizzante il fungo, da qualche ora a 2-3 giorni dopo l’ingestione con vomito, addominoalgia, diarrea e febbre.
Una buona cottura dei funghi, elimina il rischio di tossinfezioni.
Allergie:
• le allergie meglio studiate sono quelle quelle che coinvolgono il sistema immunitario e più precisamente quelle IgE mediate (trattasi di particolari e specifici anticorpi tipici delle reazioni allergiche): i sintomi gastroenterici, in caso di allergie alimentari, sono quasi sempre immediati (da pochi minuti a meno di un’ora) sempre preceduti da prurito e ponfi al cavo orale. Reazioni allergiche respiratorie sono state descritte per inalazione di spore di Agaricus bisporus e Boletus edulis; si tratta, anche in questi casi, di processi acuti con comparsa di sintomi a carico dell’albero respiratorio, come rinite ed asma, particolarmente ingravescenti in soggetti iperergici (cioè individui in grado di rispondere in maniera abnorme allo stimolo allergenico).
Indigestioni:
• bisogna ricordare che il 40% delle proteine dei funghi è costituito da micosina, che è il nome dato alla chitina presente nella parete delle cellule fungine, per distinguerla da quella presente nell’esoscheletro degli insetti e di altri artropodi o nel carapace dei crostacei. Trattasi di un polissaccaride azotato difficilmente digeribile (che non sembra provocare fenomeni di intolleranza); appare evidente che la sua digeribilità è dose dipendente: particolarmente a rischio sono i bambini e gli anziani.
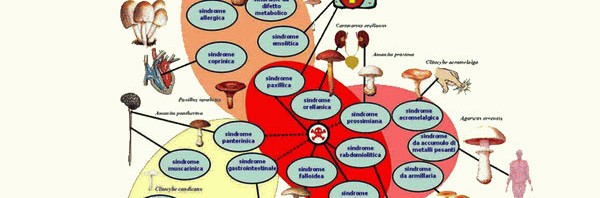
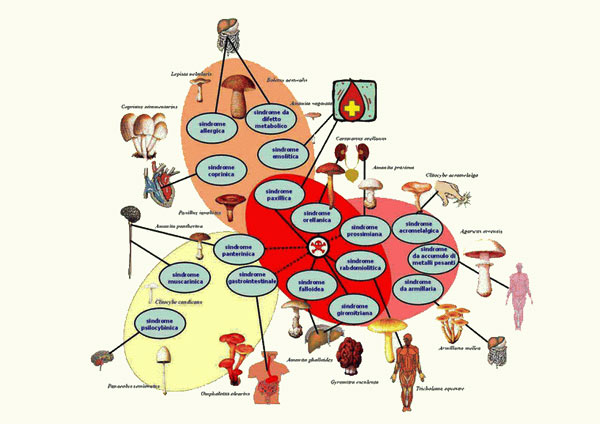
Le intossicazioni da funghi: sindromi a breve latenza
Sindromi a breve latenza (funzionali)
Prima di affrontare il vasto capitolo della micotossicologia vale la pena ricordare che solo la prevenzione e la corretta gestione di una sospetta intossicazione da funghi velenosi consentono, nella maggior parte dei casi, di evitare sgradevoli sorprese, talvolta anche letali.
Per non rendere dispersivi i contenuti abbiamo evitato di descrivere i caratteri riconoscitivi delle varie specie tossiche che saranno trattati dettagliatamente in altre occasioni.
Nel corso degli anni sono stati proposti diversi schemi classificativi delle intossicazioni da funghi. Attualmente il più utilizzato nella pratica clinica è quello di Saviuc e Flesh, pubblicato nel 2003 e basato sulle micotossine e sul tempo di latenza della sintomatologia.
 Il termine “latenza” è da preferire rispetto a quello impropriamente usato di “incubazione”, perché quest’ultimo, tipico delle malattie infettive, mal si adatta quando riferito all’introduzione passiva di sostanze velenose che certo non sono in grado di replicarsi nell’organismo ospite. Il termine “incubazione” dovrebbe essere invece riservato ai soli casi nei quali siamo in grado di dimostrare o fondatamente sospettare che i funghi in questione abbiano in qualche modo trasmesso all’uomo germi patogeni e/o tossine da essi stessi prodotti come accade tipicamente nelle tossinfezioni alimentari.
Il termine “latenza” è da preferire rispetto a quello impropriamente usato di “incubazione”, perché quest’ultimo, tipico delle malattie infettive, mal si adatta quando riferito all’introduzione passiva di sostanze velenose che certo non sono in grado di replicarsi nell’organismo ospite. Il termine “incubazione” dovrebbe essere invece riservato ai soli casi nei quali siamo in grado di dimostrare o fondatamente sospettare che i funghi in questione abbiano in qualche modo trasmesso all’uomo germi patogeni e/o tossine da essi stessi prodotti come accade tipicamente nelle tossinfezioni alimentari.
Le sindromi a breve latenza sono caratterizzate dalla comparsa precoce dei sintomi, solitamente entro le 4-6 ore dall’assunzione (a volte entro 1-2 ore); solitamente hanno un andamento benigno.
In questi casi le micotossine provocano processi morbosi in grado di ledere, a vari gradi, la funzionalità normale di un organo o di un apparato senza una evidente lesione anatomica.
Appartengono a questa categoria le seguenti sindromi:
• Sindrome muscarinica (colinergica)
• Sindrome pantherinica (micoatropinica)
• Sindrome paxillica (immunoemolitica)
• Sindrome psilocybinica (allucinogena)
• Sindropme coprinica (disulfiram simile)
• Sindrome gastroenterica (resinoide)
Sindrome muscarinica (colinergica, sudoripara)
Il veleno che provoca questa intossicazione è la muscarina: un sale d’ammonio quaternario di derivazione tetraidrofuranica, isolato nel 1869 da Oswald Schmiedeberg dall’Amanita muscaria che, a dispetto del nome, provoca sindrome micoatropinica e non muscarinica in quanto tale tossina è presente in quantità molto piccole (0,0002-0,0003 %), ma raggiunge concentrazioni tossiche del 3-4 %, in rapporto al peso dello sporoforo fresco, solo nei funghi del Genere Clitocybe [diverse specie soprattutto quelle bianche di piccola taglia, in particolare la Sezione Candicantes: Clitocybe candicans, C. cerussata (= C. ptyophyla), C. dealbata, C. nivea, e del Genere Inocybe, tra cui: Inocybe erubescens (= I. patouillardii), I. geophylla, I. lacera, I. lanuginosa, I. nanipes, ecc.]. Si sospetta che tutte le Inocybe contengono muscarina. Recentemente in Francia è stato descritto e pubblicato un caso di tipica sindrome muscarinica provocata da Mycena rosea.
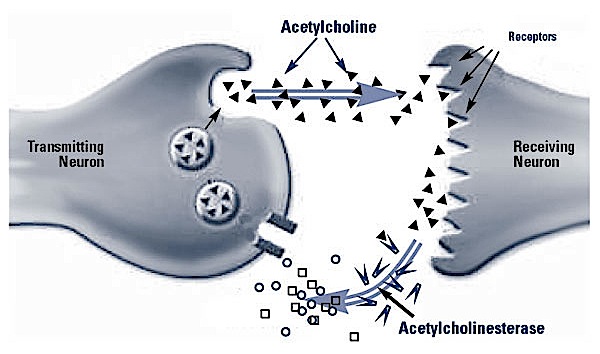
La muscarina è una tossina termoresistente con una DL50(•) calcolata in 2,5 mg/Kg e con una struttura chimica simile al neurotrasmettitore fisiologico Acetilcolina
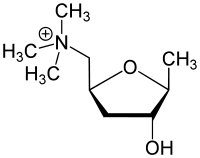
Muscarina
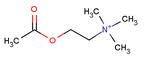
Acetilcolina
Data la sua configurazione quaternaria, la molecola della muscarina non supera la barriera ematoencefalica e per questo gli effetti clinici neurologici sono solo periferici.
La tossicità della muscarina è dovuta alla sua azione sulla branca parasimpatica del Sistema Nervoso Autonomo, dove esercita effetti simili a quelli dell’acetilcolina: si comporta cioè da agonista dei recettori colinergici (per questo prende anche il nome di sindrome colinergica), ovvero si lega a questi recettori attivandoli come il ligando naturale. In particolare agisce selettivamente su alcuni recettori. Infatti assieme alla nicotina, la muscarina ha permesso di dividere i recettori colinergici in due grandi classi, quelli nicotinici e quelli muscarinici, a seconda se legano la nicotina o la muscarina.
In buona sostanza la muscarina inganna il recettore dell’acetilcolina, comportandosi da falso neurotrasmettitore e provocando un eccesso di reazioni colinergiche sugli organi vegetativi (apparato digestivo, respiratorio, cardiovascolare, oculare). Tali effetti colinomimetici possono essere bloccati solamente dall’Atropina che agisce con un meccanismo di antagonismo specifico.
Diversamente dall’Acetilcolina, la muscarina non è idrolizzata (e quindi inattivata) dalle Acetilcolinesterasi plasmatiche per cui i suoi effetti colinergici periferici perdurano per diverse ore dopo il pasto tossico.
Il quadro clinico è caratterizzato da un periodo di latenza breve, da 15-30 minuti dall’ingestione sino a 2 ore, ed a rapida insorgenza tanto che i soggetti iniziano spesso ad avere i primi sintomi quando sono ancora a tavola. Viene spesso riferito come uno dei primi disturbi sia la difficoltà visiva, dovuta a miosi (restringimento pupillare) e cicloplegia (paralisi del muscolo ciliare con conseguente difficoltà di accomodazione del cristallino). Rapidamente compare diaforesi (sudorazione profusa) generalizzata (donde anche il nome di sindrome sudoripara), accompagnata da scialorrea (aumento della salivazione), rinorrea (abbondanti secrezioni nasali) e lacrimazione, broncocostrizione (diminuzione del calibro del lume bronchiale) e broncorrea (aumento delle secrezioni bronchiali), ipotensione (riduzione della pressione arteriosa) per vasodilatazione periferica, bradicardia (diminuzione del battito cardiaco), con possibili blocchi atrio-ventricolari. Spesso i soggetti lamentano ansietà, vertigini, tremori ed è riferita una sensazione come di morte imminente. Non esistono esami laboratoristici in grado di identificare la tossina muscarinica nelle secrezioni corporee.

La terapia è specifica (è uno dei pochi casi, nel trattamento delle intossicazioni da funghi, in cui è possibile usare un antidoto specifico): il solfato di atropina, [1-2 mg e.v. negli adulti; 0,05 mg/Kg nei bambini; la dose va ripetuta ogni 10-30 minuti fino a comparsa dei dei segni di atropinizzazione (blocco delle secrezioni)]; il compenso delle perdite idroelettrolitiche può essere necessario in taluni casi. La gastrolusi (lavanda gastrica) ed il carbone attivato sono indicati nei casi in cui la sindrome colinergica sia molto precoce e non abbia prodotto una iperemesi (vomito) spontanea ed efficace. Normalmente si assiste ad una risoluzione spontanea dei sintomi in 12-16 ore. Le intossicazioni con possibile complicanza cardiovascolare giustificano una sorveglianza in sala di rianimazione.
(•) In tossicologia il termine DL50 è l’acronimo di “Dose Letale Media” e si riferisce alla dose di una sostanza, somministrata in una sola volta, in grado di uccidere il 50% (cioè la metà) di una popolazione campione di animali da esperimento.
Riferimenti bibliografici:
C. Angelini “Le intossicazioni da funghi”; AMINT.
P.M. Soave, A. Barelli, F. Cavaliere “Intossicazioni da funghi”; ANESTESIA FORUM 2009; 2; 109-123.
V. Petrolini, C. Locatelli, N. Gervasi, L. Manzo “Gli antidoti nel trattamento delle intossicazioni da funghi con sindromi non falloidee”; C.A.V. di Pavia.
C. Locatelli, D. Maccarini, V. Lanza “Educational Sinopses in Anesthesiology and Critical Care Medicine”; vol N° 4; aprile 1999.
Sindrome pantherinica (micoatropinica, anticolinergica)

La sindrome pantherinica è caratterizzata da disturbi a carico del Sistema Nervoso Centrale (S.N.C.) con manifestazioni fisiche e psichiche. Le specie fungine responsabili sono rappresentate da Amanita muscaria, Amanita pantherina (comprese tutte le loro forme e varietà) e Amanita gemmata (= Amanita junquillea); (Amanita cothurnata e Amanita cokeri in Nordamerica).
Questi funghi, pur non contenendo alcaloidi a nucleo tropanico, possono indurre un avvelenamento definito “sindrome micoatropinica” o “Sindrome Anticolinergica Centrale” (S.A.C.) caratterizzata da sintomi simili a quelli indotti da piante atropiniche quali Atropa belladonna, Datura stramonium, Hyosciamus niger e Mandragora officinarum.
Le prime manifestazioni dell’avvelenamento compaiono precocemente da 30 minuti a 2 ore dopo il pasto tossico e sono costituiti dall’alternarsi di sintomi centrali inibitori [vertigini, sonnolenza, atassia (disturbo della coordinazione dei movimenti volontari), stato confusionale], e sintomi eccitatori di solito di breve durata [disforia (disturbo dell’umore), iperreflessia (accentuazione abnorme dei riflessi tendinei: riflesso rotuleo, riflesso achilleo, ecc.), mioclonie (contrazioni brevi e involontarie di alcuni muscoli), allucinazioni soprattutto visive, auditive o cenestopatiche (allucinazioni della sensibilità), convulsioni]. Vi può essere anche delirio, talvolta a tema religioso. Al suo risveglio, l’intossicato spesso non ricorderà nulla (amnesia retrograda). Si ha inoltre secchezza cutanea e delle mucose, tachicardia, riduzione della motilità intestinale, ipertermia, spasmo dello sfintere vescicale, arrossamento del volto e midriasi. Spesso possono manifestarsi anche disturbi gastrointestinali quali nausea, vomito e diarrea. L’intossicazione da Amanita pantherina è stata descritta invece come uno stato di ebrezza alcoolica. Dopo circa 10-15 ore dall’esordio della sintomatologia, solitamente compare cefalea (che durerà per molti mesi) nel caso di Amanita pantherina, e sonno profondo con Amanita muscaria. L’evoluzione è generalmente e spontaneamente favorevole in 12-24 ore. La terapia è aspecifica [gastrolusi (lavanda gastrica), carbone attivo per diminuire l’assorbimento delle tossine, soluzione idrosaline]
 Negli avvelenamenti gravi possono manifestarsi tremori o convulsioni tonico-cloniche (prolungate contratture muscolari alternate a fasi di rilasciamento, cui seguono movimenti ritmici del capo, del tronco e degli arti) con perdita della coscienza, perdita dei riflessi e coma. L’exitus, raro alle dosi allucinogene, può avvenire in seguito all’ingestione di oltre 10 funghi.
Negli avvelenamenti gravi possono manifestarsi tremori o convulsioni tonico-cloniche (prolungate contratture muscolari alternate a fasi di rilasciamento, cui seguono movimenti ritmici del capo, del tronco e degli arti) con perdita della coscienza, perdita dei riflessi e coma. L’exitus, raro alle dosi allucinogene, può avvenire in seguito all’ingestione di oltre 10 funghi.
Numerosi sono i principi attivi contenuti in queste entità fungine, forse ancora non completamente conosciuti dal punto di vista della loro responsabilità nella genesi della sindrome pantherinica.
Per circa un secolo la muscarina, isolata da Schimiedeberg nel 1869, era ritenuta essere il principale principio tossico dell’Amanita muscaria… questo nonostante la marcata differenza tra l’intossicazione indotta dalla sola muscarina e quella ottenuta dopo assunzione dell’intero sporoforo… la muscarina causa una elevatissima sudorazione, salivazione, lacrimazione, broncorrea, miosi, bradicardia, ipotensione e non è psicoattiva… generalmente questi aspetti non sono riscontrati con l’inebriamento dovuto all’ingestione di tutta l’Amanita muscaria. Il problema fu ulteriormente complicato quando lo stesso Schimiedeberg isolò, da un campione di muscarina commerciale, una base che neutralizza la depressione cardiaca indotta dalla muscarina. Dato che l’Atropina ed i suoi alcaloidi correlati avevano questo effetto “antimuscarinico”, la base isolata fu chiamata “pilzatropin”, dal tedesco pilz = fungo (micete) o anche “micoatropina”. Ulteriore confusione si generò quando nel 1955 venne riportato che pilzatropin altri non era che un isomero dell’Atropina: la L-josciamina, isolato da alcune specie di Amanita muscaria e Amanita pantherina Sudafricane. Come se ciò non bastasse la confusione si accentuò ulteriormente quando venne riportato che la Bufotenina (5-idrossi-N,N-dimetiltriptamina) era un principio allucinogeno dell’Amanita muscaria. Finalmente nel 1964 i veri principi neurotossici presenti in Amanita muscaria e Amanita pantherina vennero isolati quasi simultaneamente i tre diversi Paesi e si convenne, internazionalmente, di riportarli nella nomenclatura scientifica come acido ibotenico (dal giapponese “ibu-tengu-take) e muscimolo.
L’acido ibotenico ed il muscimolo sono alcaloidi strutturalmente correlabili all’isossazolo, si tratta di tossine termostabili e quindi resistenti alla cottura; il muscimolo è ritenuto 5-10 volte più attivo dell’acido ibotenico, di cui è la forma decarbossilata.
La DL50 (Dose Letale Media) è di 90 mg per l’acido ibotenico e di 5-10 mg per il muscimolo.
L’Amanita pantherina contiene una quantità di derivati isossazolici pari a 460 mg/100 g di fungo secco mentre, l’Amanita muscaria ne contiene 180 mg/100 g di fungo secco; la quantità dosata di muscimolo varia da 3 a 10 mg/100 g. Una quantità di circa 30-60 mg di acido ibotenico e 6 mg di muscimolo sono sufficienti per determinare effetti tossici.
L’acido ibotenico ed il muscimolo hanno come organo bersaglio il S.N.C. (sono infatti capaci di superare la barriera ematoencefalica), provocando blocco della trasmissione colinergica centrale; queste tossine sono in grado di espletare la loro azione anche su altri organi ed apparati, in particolare cuore, circolo, sistema gastroenterico e genitourinario per azione mediata dal Sistema Nervoso Vegetativo (conseguente a blocco del Sistema Nervoso Periferico).
Il S.N.C. contiene elevate concentrazioni di alcuni aminoacidi, in particolare acido L-glutammico e acido γ-amminobutirrico (GABA) che sono alcuni neurotrasmettitori del sistema nervoso centrale, il primo a carattere eccitatorio, il secondo inibitorio.

Il GABA si forma dalla decarbossilazione delll’acido glutammico, in una reazione catalizzata dalla glutammico decarbossilasi (GAD), enzima altamente specifico che ha come cofattore il piridossal-fosfato; (guarda caso il muscimolo si ottiene dalla decarbossilazione dell’acido ibotenico).
Gli esatti meccanismi di azione di tali sostanze non sono ancora noti, ma è stata messa in evidenza un notevole somiglianza strutturale tra l’acido ibotenico e l’acido L-glutammico e tra il muscimolo e l’acido γ-amminobutirrico (GABA), cioè con alcuni neurotrasmettitori fisiologicamente presenti a livello del S.N.C.. E’ verosimile che il muscimolo e l’acido ibotenico agiscano a livello centrale imitando i normali neurotrasmettitori che agiscono a livello dei recettori GABAergici e glutammatergici. In buona sostanza queste tossine si comportano da falsi neurotrasmettitori. Le interferenze effettuate sulla trasmissione neurologica determinano il quadro clinico allucinogeno, accompagnato da fasi di eccitazione e fasi di depressione, con sonnolenza e coma.
I funghi cosiddetti pisicoattivi possono essere divisi in due distinte classi biochimiche, psilocibinica e isossazolica. Nella prima classe, rientrano specie che producono principalmente psilocibina e psilocina (Psilocybe spp., Paneolulus spp., per lo più), mentre la seconda è caratterizzata da dalla presenza di composti isossazolici acido ibotenico e muscimolo [Amanita spp. (G. Samorini, 1993)].
Se da una parte gli effetti delle specie psilocibiniche sono ascrivibili solo alla presenza di psilocibina (o più esattamente al suo prodotto defosforilato, psilocina), dall’altra questo non può dirsi per Amanita muscaria. L’acido ibotenico e il muscimolo sono stati riconosciuti come i composti principalmente responsabili degli effetti allucinogeni di Amanita muscaria, ma non rendono conto di tutti.
In ricerche sperimentali con volontari, l’ingestione di quantità variabili di acido ibotenico e muscimolo sintetici non hanno determinato le allucinazioni “strutturali” normalmente riportate per Amanita muscaria. Ciò ha permesso di ipotizzare che altri composti possano influire sull’effetto di acido ibotenico e muscimolo. Nel fungo in questione, oltre all’acido ibotenico e al muscimolo, sono presenti composti che potrebbero contribuire all’effetto generale. Per essi spesso mancano studi farmacologici specifici, oppure molti si sono dimostrati inattivi alle concentrazioni effettivamente presenti nei funghi. (F. Festi & A. Bianchi, 1991). Entrambi i composti sono presenti in maggiore concentrazione nel cappello rispetto al gambo, nei campioni estivi rispetto a quelli autunnali e in quelli giovani rispetto a quelli adulti. Inoltre essi sembrano essere più concentrati nella cuticola rossa del cappello e nello strato giallo di tessuto appena sottostante. L’acido ibotenico si trasforma in muscimolo secondo un processo di decarbossilazione durante l’essiccazione del fungo, processo che viene preventivamente seguito prima dell’ingestione, in modo da indurre maggiori effetti psicoattivi e minori effetti collaterali.
Le fasi critiche dell’intossicazione sono la fase eccitatoria con convulsioni e il coma durante il quale, nei casi più gravi (seppur raramente e per grandi assunzioni) può comparire paralisi respiratoria.
Il trattamento si basa sulla decontaminazione gastroenterica, sulla terapia sintomatica e sulla terapia antidotica specifica rappresentata dalla Fisostigmina (antidoto di scelta nella S.A.C.), sotto forma di salicilato.
La Fisostigmina è il principale alcaloide a struttura indolica presente nei semi della Physostigma venenosum, una pianta della Famiglia delle Fabaceae che cresce spontaneamente nell’Africa occidentale, in particolar modo nella Guinea, lungo le sponde del fiume Calabar, conosciuta anche come fava del Calabar.
La fava del Calabar fu portata in Inghilterra dall’ufficiale medico Daniell di stanza nel Calabar nel 1840. I primi studi sulle proprietà farmacologiche vennero condotti tra il 1850 e il 1860 e un alcaloide puro fu isolato nel 1864 da Jobst ed Hesse e fu chiamato Fisostigmina. Il primo uso terapeutico fu nel glaucoma che rappresenta ancora oggi la sua principale applicazione. Si tratta di un alcaloide a struttura terziaria e per questo in grado di superare agevolmente la barriera ematoencefalica. La somministrazione i.v. di Fisostigmina reverte la maggior parte degli effetti centrali e periferici indotti da Atropina e da altri agenti antimuscarinici correlati, in quanto è in grado di inibire reversibilmente l’Acetilcolinesterasi, enzima deputato all’idrolisi dell’Acetilcolina, conseguentemente si ha un aumento dei livelli extracellulari di Acetilcolina.
I principali effetti prodotti dalla somministrazione di Fisostigmina sono i seguenti:
• miosi;
• aumento delle secrezioni ghiandolari (bronchiale, lacrimale, sudoripara, salivare, gastrica);
• bradicardia e conseguentemente riduzione della pressione arteriosa;
• riduzione della pressione oculare.
Ritornando sul trattamento da effettuare, la gastrolusi potrà essere praticata anche tardivamente per via del blocco della peristalsi determinato dall’azione anticolinergica periferica; l’aggiunta del carbone attivato è possibile al termine della gastrolusi. L’induzione del vomito, utilizzando Ipecacuana sciroppo può essere preferita, soprattutto nei bambini (10-15 ml di sciroppo al 7% seguiti da 150-250 ml di acqua), al lavaggio gastrico in caso di pasto recente e non si sono presentati i segni neurologici. Le manifestazioni neurologiche, come le allucinazioni, la confusione mentale, i deliri, le convulsioni fino alla letargia (stato patologico di sonno profondo) richiedono l’uso di un antidoto: la Fisostigmina, un inibitore reversibile della Aceticolinesterasi. La sua struttura chimica, un’ammina terziaria, le permette di attraversare il filtro encefalico e di essere attiva anche a livello centrale. Agisce elevando il tasso di Acetilcolina rispristinando così la conduzione colinergica ed antagonizzando gli effetti centrali e periferici delle sostanze anticolinergiche. A livello centrale rende reversibile il coma, delirio, allucinazioni, convulsioni e gli effetti extrapiramidali della S.A.C.. A livello periferico risulta invece meno efficace contrastando solo parzialmente tachicardia, ileo, iperpiressia, ritenzione urinaria, vasodilatazione periferica, e la diminuzione delle secrezioni cutanee e mucose; la midriasi può persistere per 2 o più giorni. (Gelman & Conner, 1984).
La dose iniziale negli adulti è di 0,5-2 mg per via endovenosa lenta (in 5 minuti); nei bambini 0,02-0,06 mg/Kg (in 5 minuti), ripetibili dopo 5-10 minuti se non si ottiene l’effetto desiderato (fino ad un massimo di 4 mg in ½ ora nell’adulto e 2 mg in ½ ora nel bambino). L’effetto clinico tuttavia, è di breve durata (20-60 minuti) data la breve emivita della Fisostigmina, per cui possono rendersi necessarie ripetute somministrazioni (Bozza – Marrubini et al, 1987; Gelman & Conner, 1984; Lewin, 1986).
Il farmaco può, in alcuni casi, precipitare convulsioni, crisi colinergiche, midriasi, ileo paralitico, ritenzione urinaria, bradiaritmie e asistolia, ipotensione, tachicardia ventricolare e fibrillazione atriale. Alcuni Autori, considerando la possibilità di questi importanti effetti collaterali, ne raccomandano l’uso solo in caso di:
1. allucinazioni e agitazioni che possano determinare grave autolesionismo;
2. aritmie sopraventricolari con instabilità emodinamica;
3. presenza di convulsioni insensibili ai normali trattamenti anticonvulsivanti;
4. aritmie ventricolari insensibili a Lidocaina e Fenitoina (Kulig & Rumack, 1983).
Le controindicazioni relative all’uso del farmaco sono rappresentate da asma, gangrene, malattie cardiovascolari e ostruzione meccanica del tratto gastroenterico o urinario (Lewin, 1986).
Gli effetti collaterali o tossici indotti dalla terapia antidotica sono contrastabili dall’Atropina alla dose di 0,5-1,5 volte il dosaggio di Fisostigmina somministrato (Kulig & Rumack, 1983; Locatelli et al, 1989).
Riferimenti bibliografici:
• S. Pichini, I. Palmi, E. Marchei, M. Pellegrini, R. Pacifici, P. Zuccaro “Smart Drugs”; Dipartimento del Farmaco – Osservatorio Fumo Alcool e Droga; Istituto Superiore di Sanità Roma.
• P. M. Soave, A. Barelli, F. Cavaliere “Intossicazioni da funghi”; Istituto di Anestesia e Rianimazione, Università Cattolica del Sacro Cuore, Roma; ANESTESIA FORUM 2009; 2; 109-123.
• Jonathan Ott, “Pharmacoteon”
• C. Angelini “Le intossicazioni da funghi”; AMINT.
• B. Andreoni “Assistenza domiciliare integrata”; MASSON Editore.
• G. Toro “Amanita muscaria: chimica e psicoattività”; Il Chimico Italiano, n. 2 mar/apr 2009.
• V. Petrolini, C. Locatelli, N. Gervasi, L. Manzo “Gli antidoti nel trattamento delle intossicazioni da funghi con sindromi non falloidee”; Servizio di Tossicologia – Centro Antiveleni di Pavia.
• AA. VV. “Dispense di Farmacognosia”; Università degli Studi di Firenze.
• C. Locatelli, D. Maccarini, L. Manzo, “Educational Synopses in Anesthesiologyst and Critical Care Medicine”; vol. 4 n° 4, aprile 1999.
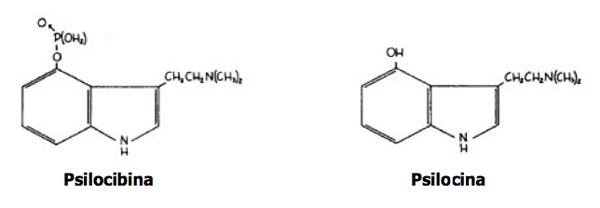
Sindrome psilocibinica

La sindrome psilocibinica detta anche “micetismo cerebrale”, è causata prevalentemente da funghi appartenenti al Genere Psilocybe, consumati crudi oppure essiccati. Gli effetti di tali funghi erano già noti agli antichi popoli del continente americano. Gli Aztechi, per esempio, chiamavano tali funghi “teonanácatl” (“carne degli Dei”) e li consumavano soprattutto durante le cerimonie religiose per preparare le vittime sacrificali e sono tuttora utilizzati nel Centro America a scopo voluttuario. Essi provocano una sindrome allucinogena, simile a quella causata dall’acido lisergico (LSD), che compare entro pochi minuti dall’assunzione ed è caratterizzata da atassia (disturbo della coordinazione dei movimenti volontari), allucinazioni ed ipercinesia (manifestazione neurologica caratterizzata da involontaria, non coordinata attività motoria distrettuale). Attualmente l’intossicazione dovuta a questi funghi può essere osservata anche nei paesi europei, Italia compresa, dove i funghi sono appositamente coltivati o possono essere acquistati via Web.
Il tempo di latenza è molto breve e i primi segni clinici compaiono precocemente in meno di 1 ora. Le tossine responsabili sono principalmente psilocibina (defosforilata a livello epatico nella sua forma attiva che è la psilocina), ed in minor misura la serotonina (sono state isolate anche altre sostanze come la bufotenina, beocistina e norbeocistina, ma il loro effettivo coinvolgimento in questa sindrome è ancora oggi oggetto di studio).
I due alcaloidi vennero isolati nel 1958 dal chimico svizzero Albert Hofmann dai funghi fornitigli da Wasson. Trattasi per lo più di derivati dell’indolo (alcaloidi indolici) dotati di struttura chimica molto simile alla dietilammide dell’acido lisergico (LSD-25) che agiscono soprattutto a livello dei recettori serotoninergici. L’acido lisergico e la psilocibina costituiscono i primi due esempi di indoli naturali con una sostituzione nella posizione 4 delle molecole.
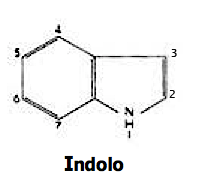
Tre delle quattro posizioni libere nel nucleo indolico possono dare origine a composti ben studiati e di notevole interesse psicofarmacologico anche se per ragioni differenti fra loro.
I 4 sostituiti sono prodotti naturalmente nei funghi.
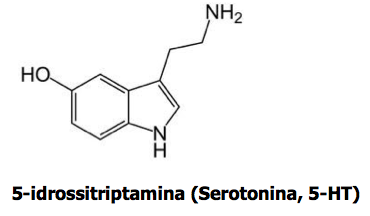
I 5 sostituiti devono il loro interesse al fatto di annoverare tra loro uno dei più importanti neurotrasmettitori cerebrali, la 5-idrossitriptamina, meglio nota come Serotonina.
A differenza di altre sostanze (exstasy), secondo alcuni autori, non provocano danni permanenti al S.N.C. e non danno dipendenza (come gli oppiacei). Sono invece responsabili di tolleranza (٭), per cui nei consumatori abituali sono necessarie dosi sempre maggiori nel tempo per ottenere analogo effetto. Tuttavia, secondo altri, il consumo prolungato di funghi allucinogeni può provocare gravi danni cronici al S.N.C., ad esempio, con attacco di panico, psicosi, allucinosi croniche. La dose di LSD efficace nell’uomo è di 0,1 mg, mentre quella della Psilocibina è di 20 mg. Psilocybe cyanescens, il più comune e rappresentativo fungo allucinogeno europeo, [rinvenuta anche in Calabria, in habitat boschivo sull’Aspromonte (Grilli, 1990)], contiene mediamente 12 mg/g di Psilocibina, per cui sono sufficienti 10-20 g di fungo fresco (1-3 g di fungo secco) per determinare sintomatologia (4-6 mg di Psilocibina provocano ebrezza, euforia; 6-20 mg, provocano allucinazioni).
Vi sono nel mondo più di 120 specie di funghi allucinogeni (accertata per il momento la presenza di una ventina di specie in Italia) appartenenti a diversi gruppi tassonomici:
Genere Psilocybe: P. semilanceata, P. cyanescens, P. callosa, P. inquilina, P. rhombispora, P. montana, P. merdaria, P. coprophila, P. crobula, P. musorum, P. semistriata e P. physaloides le specie italiane-europee più comunemente contenenti psilocibina ed almeno altre 15-20 specie tropicali, fra cui le più famose sono: P. mexicana, P. atzecorum, P. sempreviva (coltivabile) e P. zapatecorum.
Genere Paneolus: due le specie italiane contenenti costantemente psilocibina: Paneolus cyanescens e P. subbalteatus. Altre specie sono invece psilocibine-latenti: Paneolus ater, P. fimicola, P. sphinctrinus, P. acuminatus, P. campanulatus, P. retirugis, P. semiovatus ed almeno altre 10-15 specie tropicali.
Genere Stropharia: S. rugosoannulata, S. semiglobata e molte altre specie europee (S. cubensis e S. venerata le specie tropicali più note). Non tutti gli Autori riconoscono come allucinogeni le specie rientranti in questo Genere.
Genere Gymnopilus: Gymnopilus spectabilis e forse altre specie (G. fulgens) ed altre 3-4 specie americane.
Genere Mycena: Mycena pura (e probabilmente anche M. rosea e M. pellianthina), e anche in alcune specie del Genere Conocybe: Conocybe cyanopus, C. subovalis e C. pubescens), del Genere Psathyrella: Psathyrella candolleana, del Genere Inocybe: Inocybe aeruginascens ed in alcune specie della Famiglia delle Polyporaceae.
Questo tipo di intossicazione è generalmente volontario e a scopo ricreativo. Il tempo di latenza è molto breve e i primi segni clinici compaiono da 30 minuti a 1 ora, per durare 2-4 ore, per poi regredire spontaneamente in 12-48 ore.

L’effetto mentale della psilocibina, a somiglianza di quanto si verifica anche con le altre sostanze psichedeliche (e particolarmente con l’LSD e altri allucinogeni di tipo indolico), è preceduto e accompagnato da chiari e non sempre gradevoli effetti fisici.
Durante la prima mezz’ora, uno dei segni più costanti è rappresentato dall’arrossamento del volto; possono poi comparire vertigini soggettive (il soggetto prova sensazioni di instabilità e movimento e li riferisce al proprio corpo e non agli oggetti dell’ambiente) e instabilità alla deambulazione. frequentemente compaiono nausea e dolori addominali, un senso di debolezza generale, dolori muscolari diffusi, fascicolazioni (contrazione casuale di porzioni di muscoli) e lievi tremori. Meno frequentemente il soggetto è ansioso, irrequieto e accusa una perdita di sensibilità alle labbra e alla lingua. Entro 30-60 minuti compaiono i primi effetti mentali, principalmente visivi, mentre gli effetti fisici della prima mezz’ora si attenuano e vanno scomparendo. Col progredire dei tempo gli effetti mentali diventano preponderanti dirottando l’attenzione dal corpo alla mente. Il soggetto può tuttavia avvertire di essere disturbato da fenomeni fisici quali disturbi della coordinazione dei movimenti, sudorazione profusa, lacrimazione involontaria e tremolio della voce, che costituiscono il proseguimento degli effetti fisici della psilocibina. Circa verso l’inizio della seconda ora dall’ingestione della sostanza comincia l’esperienza psichedelica vera e propria, contrassegnata, da allucinazioni visive vividamente colorate e percepite anche a occhi chiusi. Il soggetto è euforico, tende a elaborare con logica minuziosa qualunque stimolo sensitivo, associandolo a significati astratti; ha l’impressione che il suo cervello percepisca più sensazioni dall’esterno di quante non ne riceva normalmente e ha l’impressione che il tempo scorra più lentamente dell’ordinario o talvolta
più veloce. Durante la terza ora gli effetti cominciano ad attenuarsi e durante la quarta a svanire. In questa fase gli effetti fisici gradevoli o sgradevoli, appariscenti o sfumati che siano, sono scomparsi. Tra le 4 e le 12 ore si ha il completo recupero della normalità. Durante il rientro può manifestarsi qualche disturbo, quale senso di fatica e di spossatezza e, soprattutto, abbastanza frequentemente, può comparire cefalea. Tra i fenomeni fisici meno frequenti associati all’ingestione di psilocibina sono state segnalate parestesie, dispnea (difficoltà respiratoria), scomparsa dell’appetito e transitori desideri sessuali (Hollister et. al., 1960).
La maggior parte dei prodotti di degradazione viene eliminata, attraverso l’urina, la bile e le feci, entro 8 ore dopo l’ingestione. Tracce dei metaboliti possono persistere nelle urine fino ad una settimana dopo l’assunzione.
Non è ancora chiaro come le sostanze psichedeliche agiscano sul S.N.C.. La teoria più comunemente accettata è quella della somiglianza con la Serotonina, che le fa accettare dal cervello, infatti tutte queste sostanze hanno in comune l’anello indolico. La trasmissione dell’impulso nervoso sulle aree cerebrali, dipende da un fattore positivo, l’Acetilcolina che favorisce il passaggio e da un fattore negativo equilibrante, la Serotonina che inibisce tale fenomeno. Nel cervello la scorta di Serotonina è continuamente rinnovata partendo dal Triptofano e successivamente ossidata in acido 5-idrossi-indolacetico espulso con le feci ed acido indolacetico eliminato con le urine.
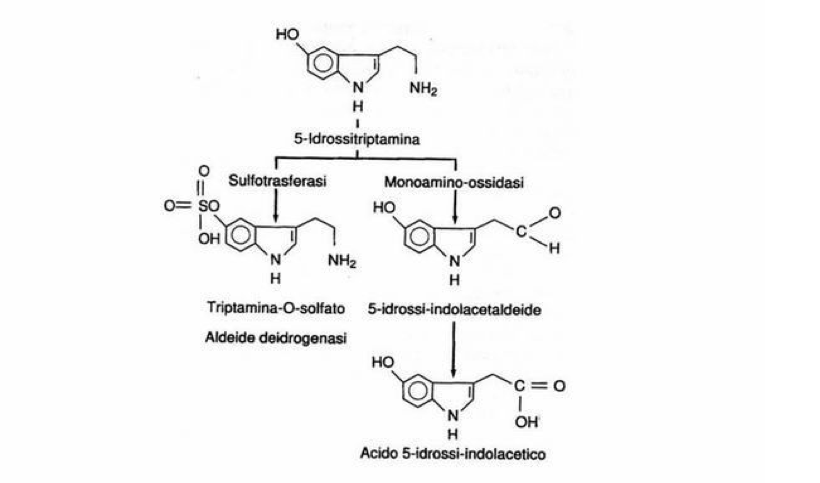
La Monoamino-ossidasi (MAO), enzima preposto a tale trasformazione, si combinerebbe con la molecola dell’allucinogeno bloccandone il suo funzionamento. Ciò causerebbe un accumulo dell’ammina nel cervello, con conseguente stato di iper eccitazione. Si ritiene che gli effetti allucinogeni siano determinati dalla presenza in posizione 4 o 5 di un gruppo ossidrilico e dalla metilazione dell’N nella catena laterale. Infatti il Triptofano e la Triptamina non producono effetti allucinogeni.
La tossicità cronica induce disturbi percettivi persistenti (immagini fluttuanti o persistenti, lampi di luce aumentati da stress, stanchezza, oscurità) e schizofrenia,, tali sintomi sono aggravati dall’uso contemporaneo di cannabis. La tolleranza agli effetti della psilocina e della psilocibina si sviluppa rapidamente, al punto che è necessario un uso discontinuo della droga per continuare ad avere gli stessi effetti.
La terapia si basa sulla gastrolusi entro le 2 ore dall’ingestione, sulla somministrazione di carbone attivo, sull’idratazione, sul ricovero in un ambiente silenzioso e poco illuminato e sulla sedazione con Diazepam (Valium®), 10-20 mg i.v. 3 volte al giorno, sino a scomparsa dei sintomi, [da preferirsi alle Fenotiazine, il cui capostipite è la Clorpromazina (Largactil®)], che sono caratterizzate da un possibile effetto preconvulsivante).
(٭) capacità dell’organismo di sopportare, a dosi gradualmente più elevate, la tossicità della sostanza.
Riferimenti bibliografici:
• K. Kob “Manifestazioni cliniche e terapia nelle intossicazioni da funghi allucinogeni”, 3°
Convegno Internazionale di Micotossicologia”, A.M.B. Bresadola, Reggio Emilia 2004.
• P. M. Soave, A. Barelli, F. Cavaliere “Intossicazioni da funghi”, Istituto di Anestesia e
Rianimazione, Università Cattolica del Sacro Cuore, Roma.
• P. Angeli, E. Lazzarini, R. Para “I funghi tossici e velenosi”, HOEPLI Editore, Milano.
• C. Angelini “Le intossicazioni da funghi”, AMINT.
• M. Margnelli “I funghi magici”, EDITIEMME Edizioni, Milano.
• Di Candia, F. Gigli, F. Lodi “Concentrazioni di psilocina e psilocibina in campioni di differente
matrice vegetale”, Sezione di Tossicologia Forense, Dipartimento di Fisiologia Umana,
Università degli Studi di Milano.
• V. Gemelli “Aspetti morfo-botanici dei funghi allucinogeni”, 3° Convegno Internazionale di
Micotossicologia, A.M.B. Bresadola, Reggio Emilia 2004.
Sindrome coprinica (Disulfiram simile)

Coprinus atramentarius
La tossina, responsabile di questa sindrome, è la Coprina (composto aminoacidico derivato dal Ciclopropanone) o N-(1-idrossiciclopropil)-L-glutamina:

Questa tossina, pur presentando una struttura chimicamente diversa dal Disulfiram, determina gli stessi effetti di quei farmaci che venivano usati in passato per il loro effetto “Antabuse” cioè per dissuadere gli alcolisti cronici all’uso dell’alcool.
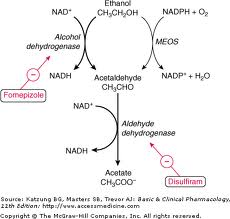
Il meccanismo d’azione è legato al fatto che la Coprina ed i suoi derivati (1-aminociclopropanolo) bloccano la degradazione dell’alcool a livello di acetaldeide che è sostanza tossica per l’organismo (il blocco avviene per inibizione diretta della Coprina sull’enzima Acetaldeide-deidrogenasi che altrimenti catalizzerebbe la trasformazione dell’acetaldeide in acido acetico, sostanza non tossica per l’uomo).
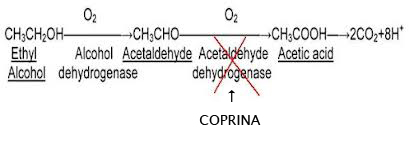
Questo meccanismo è analogo a quello del Disulfiram (Antabuse™):
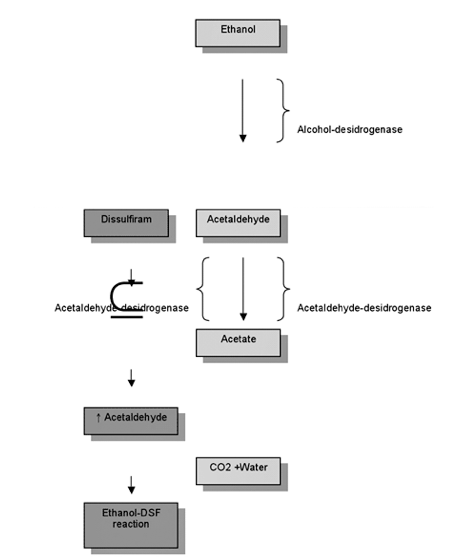
Così, l’ingestione di alcool durante o dopo, e fino al terzo giorno dal pasto, provoca un effetto “Antabuse” per inibizione del metabolismo dell’alcool etilico allo stadio dell’acetaldeide.
I funghi responsabili sono sicuramente il Coprinus atramentarius, ma anche diverse altre specie fungine hanno saltuariamente fatto registrare degli effetti “Antabuse” più o meno rilevanti, se consumate congiuntamente a bevande alcooliche (Coprinus alopecia, Clitocybe clavipes e Boletus luridus, nonché, secondo altri Autori, Tricholoma equestre, Laetiporus sulphureus, Morchella s.l. e Ptychoverpa bohemica). Poiché questi effetti sono alquanto sporadici e legati verosimilmente ad una grandissima variabilità individuale, i funghi qui elencati non possono essere ritenuti in assoluto velenosi, ma certo da considerare con una certa precauzione.
Il quadro clinico compare dopo una latenza variabile dai 30 minuti fino ad un’ora, ed è caratterizzato da vasodilatazione periferica generalizzata, che nei casi gravi può degenerare in collasso, colpi di calore, eritrosi facciale (arrossamento delle guance), polipnea (aumento della frequenza respiratoria), eretismo cardiovascolare con tachicardia, ipotensione arteriosa, stato di angoscia, tremori alle estremità, sudorazione. Più raramente compaiono sintomi gastroenterici quali nausea, vomito e diarrea. In alcuni casi è stata riportata la comparsa di sintomi anche dopo qualche giorno dall’ingestione del fungo, mentre in alcuni soggetti vi può essere una totale assenza di sintomi. Questo fatto può trovare spiegazione nella diversa tolleranza individuale verso le sostanze alcooliche. E’ stata anche segnalata la possibilità che anche l’uso di dopobarba a base alcoolica possano indurre la comparsa della tipica sintomatologia in soggetti che avevano consumato Coprinus atramentarius nelle 40-72 ore precedenti.
L’evoluzione è spontanea e favorevole nella maggior parte dei casi ed avviene in alcune ore. Per i casi più impegnativi, tuttavia, è stata ipotizzata la possibilità di utilizzare un inibitore dell’Alcool-deidrogenasi: il Fomepizolo, ff. 1,5 g/1,5 ml, (Antizol™), farmaco non registrato in Italia.
Questo inibendo la prima via metabolica dell’etanolo e quindi la formazione di acetaldeide, potrebbe prevenire o limitare la comparsa di effetti tossici. Questa applicazione di trattamento antidotico è tuttavia, allo stato attuale, puramente teorica:
il Fomepizolo è un farmaco altamente costoso e scarsamente disponibile, e la sindrome coprinica una patologia in genere trattabile con terapia sintomatica.
Riferimenti bibliografici:
C. Angelini “Le intossicazioni da funghi”, AMINT.
V. Petrolini, C. Locatelli, N. Gervasi, L. Manzo “Gli antidoti nel trattamento delle intossicazioni da funghi con sindromi non falloidee”; Servizio di Tossicologia, C.A.V. di Pavia
Sindrome paxillica (immunoemolitica)

Paxillus involutus
Non è da considerarsi un vero e proprio micetismo, ma una grave “allergia alimentare” dovuta ad un antigene proteico, denominato Involutina, presente nei funghi Paxillus involutus e Paxillus filamentosus (= P. rubicundulus). In realtà sono stati segnalati anche alcuni casi con il consumo ripetuto di altre specie fungine quali il Suillus luteus ed il Boletus luridus.
Non colpisce quindi tutte le persone, ma soltanto quelle precedentemente sensibilizzate.
Al primo contatto con l’antigene contenuto nel fungo, la persona sensibile sviluppa la formazione di anticorpi specifici che vanno a localizzarsi sulla membrana dei globuli rossi. In questo modo gli eritrociti risultano sensibilizzati verso tale sostanza. L’eventuale nuova ingestione della stessa specie fungina scatena immediatamente una reazione allergica: la reazione antigene-anticorpo determina conseguentemente la lisi dei globuli rossi.
Rara, ma potenzialmente mortale, questa sindrome da immunocomplessi vanta una vittima illustre: il grande micologo tedesco Julius Schäffer, specialista del Genere Russula, avvenuta nel 1944. In quel periodo si era in piena II guerra mondiale e la carestia imperava. Lo Schäffer, che era dedito allo studio dei funghi e non al loro consumo, ad un certo punto, preso dai morsi della fame, se ne cibò ed il pasto gli fu fatale.
Questa sindrome ha un comportamento strano: può presentarsi lentamente a seguito di pasti ravvicinati, oppure rapidamente in modo drammatico.
Arietti & Tomasi (1975), parlando del Paxillus involutus come di specie subdola, riportano casi di persone che da anni facevano uso senza conseguenze e che improvvisamente si sono avvelenati con gravi disturbi.
La latenza può andare dai 30 minuti alle 2-3 ore dall’ingestione e talora si spinge fino a 9 ore.
La sintomatologia è caratterizzata da nausea, dolore epigastrico, diarrea, ittero emolitico, emoglobinuria (comparsa di emoglobina nelle urine) e successivamente marcata riduzione della diuresi (dall’oliguria fino all’anuria), collasso cardiocircolatorio, insufficienza renale acuta e stato di shock.
Si tratta di una classica e grave forma di anemia emolitica autoimmune (AEA) la cui prognosi può essere infausta senza un adeguato trattamento medico.La terapia prevede la decontaminazione gastrica (gastrolusi, carbone vegetale attivato) ed una terapia di supporto basata sull’uso di cortisonici, antistaminici, idratazione con soluzioni polisaline che permettono di protegge il rene. In caso di grave emolisi, può essere praticata la trasfusione di sangue, o la somministrazione di sostituti plasmatici.
Riferimenti bibliografici:
C. Angelini “Le intossicazioni da funghi”; AMINT.
P. Angeli, E. Lazzarini, R. Para “I funghi tossici e velenosi”; HOEPLI Milano.
M. della Maggiora, Micoponte 1 – 2007: 24-40.
P.M. Soave, A Barelli, F. Cavaliere “Intossicazioni da funghi”; ANESTESIA FORUM 2009; 2; 109-123.
Sindrome gastroenterica (livida, pardinica, resinoide, catartica)

Tricholoma pardinum
Viene definita anche sindrome livida in quanto provocata dall’ingestione di Entoloma lividum, o pardinica poiché conseguente al consumo di Tricholoma pardinum, oppure resinoide per via delle sostanze acroresinose (ad azione irritante sulla mucosa gastroenterica) contenute in alcune specie fungine ed infine catartica perché promuove l’evacuazione delle feci in maniera piuttosto drastica. E’ la più frequente in senso assoluto (rappresenta da sola oltre il 90% di tutte le intossicazioni da funghi), sia perché la maggior parte delle specie velenose provoca specificatamente questa sindrome, sia perché tutti i funghi commestibili possono diventare tossici per tutta una serie di cause, o perché si ha a che fare con funghi a commestibilità condizionata mal preparati. In ogni caso si ha un analogo effetto, indistinguibile dal precedente sia su base clinica che chimico-clinica. Si tratta comunque di una sindrome a conclusione benigna, la cui gravità varia da semplici episodi dissenterici a situazioni più gravi, con il coinvolgimento di tutto l’apparato digerente, in maniera così violenta da simulare una sindrome falloidea e da richiedere un trattamento aggressivo in attesa di un riconoscimento micologico sicuro.
Il tempo di latenza è normalmente breve, 1-3 ore dopo il pasto (fino a 6-8 ore in Tricholoma pardinum, Entoloma sinuatum e Omphalotus olearius), eccezionalmente fino a 10-12 ore con certe specie fungine (Armillaria mellea ed Entoloma lividum).
Di norma la sintomatologia, caratterizzata da nausea, vomito, dolori addominali e successivamente diarrea, dura alcune ore, ma in alcuni casi anche alcuni giorni; nei casi più gravi (dovuta al consumo di grandi quantità), o per ingestione di alcune specie (Tricholoma pardinum ed Entoloma sinuatum), i sintomi possono durare anche per una settimana.
Risulta spesso difficile, se non addirittura impossibile, distinguere un episodio di sindrome gastroenterica generica dovuto al consumo di cibi più o meno avariati o contaminati, da un’intossicazione da funghi sia “vera” che “falsa” per analogia dei sintomi e del decorso clinico. Allo stato attuale, essendo il quadro clinico del tutto aspecifico, la diagnosi è quasi solamente di pertinenza micologica (presenza/assenza di funghi patogeni nell’alimento ingerito).

Entoloma lividum
I principi attivi responsabili sono molteplici e non sempre è stato possibile isolarli: agiscono per contatto provocando irritazione della mucosa gastrointestinale. Per alcune entità fungine si sono potute isolare specifiche sostanze tossiche ritenute capaci di determinare il quadro clinico, da sole o in associazione con altre ancora sconosciute. Questi casi sono rappresentati, per esempio, dagli Agaricus del gruppo Xanthodermatei nei quali è stato isolato Fenolo in quantità tale da provocare da solo la sintomatologia intestinale; in Albatrellus cristatus è stata invece dimostrata la presenza degli Acidi grifolinici, scutegeralici e ristatici; in Tricholoma ustale l’Acido ustalico; Hypholoma fasciculare e Hypholoma sublateritium conterrebbero Fasciculolo E ed F, Naematolina e Naemetolone; in Omphalotus olearius e Omphalotus illudens sono state isolate varie sostanze tra cui l’Illudin S (un sesquiterpenico). Due sostanze alcaloidi, Lepiotin A e Lepiotin B sono state isolate in Macrolepiota neomastoidea mentre Chlorophyllum molybdites (ex Lepiota morganii, da cui deriva il nome della relativa sindrome d’oltre oceano, il <morganismo>) contiene il solo Lepiotin B; per queste due ultime sostanze alcaloidi, oltre ad essere coinvolto l’apparato gastroenterico, verrebbero anche colpiti il sistema nervoso centrale e l’apparato cardiocircolatorio. La terapia è esclusivamente sintomatica (gastrolusi, carbone attivo e terapia reidratante), la prognosi è generalmente favorevole.
Riferimenti bibliografici:
• C. Angelini “Le intossicazioni da funghi; AMINT.
• P.M. Soave, A. Barelli, F. Cavaliere “Intossicazioni da funghi”; ANESTESIA FORUM 2009; 2:
109-123.
• P. Angeli, E. Lazzarini, R. Para ”Funghi tossici e velenosi”; HOEPLI Editore – Milano.
Le sindromi a lunga latenza

Amanita phalloides
Le manifestazioni cliniche, associate all’ingestione di funghi velenosi o non commestibili, sono varie e in rapporto con la specie fungina implicata. Lo schema del periodo di latenza dei sintomi, in caso di ingestione di funghi non controllati, può aiutare ad inquadrare il problema, si presume che una latenza da 30 minuti a 6 ore dal pasto non comporti danni d’organo di particolare gravità; una latenza maggiore alle 6 ore è da considerare potenzialmente pericolosa e può determinare un’alta incidenza di mortalità. Però la contemporanea ingestione di specie fungine diverse, comporta la presenza di manifestazioni cliniche miste e una breve latenza può mascherarne una più lunga. I sintomi delle sindromi a lunga latenza inizialmente possono simulare una gastroenterite di tipo influenzale, così che il paziente e lo stesso medico curante sottovalutano il rischio, tanto che si ricorre all’ospedalizzazione e alla cura tardivamente, compromettendo a volte in maniera irreparabile, lo stato di salute.
Le sindromi a lunga latenza (o Sindromi maggiori) comprendono:
Sindrome falloidea
Sindrome orellanica
Sindrome giromitrica*
Sindrome acromelalgica*
Sindrome norleucinica*
Sindrome rabdomiolitica*
Sindrome di Szechwan*
Sindrome cerebrale
Sindrome encefalopatica
*dovute comunque ad accumulo che si verifica quando specifici funghi vengono consumati in quantità esagerate e/o in numero elevato di pasti ravvicinati (in 1-3 giorni).
In generale e per non incorrere in effetti collaterali, viene consigliato di consumare non più di 200 g di funghi freschi alla settimana (Linee guida del Ministero della Sanità tedesco). La quantità massima di assunzione di funghi edibili freschi per pasto è stata calcolata mediamente in 300 g (corrispondente a 5 g di fungo fresco per Kg di peso corporeo; (Tofani L., 2003). Tale quantità, già di per se considerevolissima, viene di norma superata.
Analizzeremo tutte le sindromi a lunga latenza nei prossimi articoli.
Riferimenti bibliografici
• Francesca Assisi et al. “Intossicazioni da funghi”: Epidemiologia del CAV di Milano – 16° Congresso Nazionale della Società Italiana di Tossicologia, Giardini Naxos (ME), 21-23 marzo 2012.
• Claudio Angelini “Le intossicazioni da funghi”; AMINT.
Sindrome phalloidea

Questa sindrome ha rappresentato nell’arco degli anni l’avvelenamento da funghi con più frequente esito mortale. Attualmente il tasso di mortalità è sceso significativamente attestandosi, quando i casi sono stati trattati appropriatamente ed in tempo utile, al 10% del totale. Le tossine responsabili, ampiamente note e studiate, sono generalmente divise in tre gruppi: amatossine, fallotossine, virotossine. Come di seguito meglio specificato, sono solo quelle relative al primo gruppo (amatossine) le vere tossine responsabili di questa sindrome che, per comodità, si continua ancora a definire “falloidea”. In passato si parlava di “Sindrome falloidea” (provocata solamente da alcune specie fungine appartenenti al Genere Amanita) e di “Sindrome parafalloidea” (provocata da specie appartenenti ad altri generi fungini). Considerato che le tossine responsabili sono identiche ed i quadri clinici perfettamente sovrapponibili, oggi si preferisce considerare un’unica sindrome falloidea che le comprende entrambi.
 Le specie fungine responsabili della sindrome falloidea sono: per il Genere Amanita: A. phalloides, A. phalloides var. alba, A. verna, A. virosa, A. porrinensis (e altre specie di Amanita americane); per il Genere Galerina: G. marginata, G. autmnalis, G. venenata, ecc.; per il Genere Conocybe: C. filaris e probabilmente altre specie; per il Genere Lepiota: L. helveola, L. lilacea, L. subincarnata (= L. josserandii), L. brunneoincarnata, ecc.. Segnalata, ma ancora non confermata, la presenza di amatossine in Lepiota cristata.
Le specie fungine responsabili della sindrome falloidea sono: per il Genere Amanita: A. phalloides, A. phalloides var. alba, A. verna, A. virosa, A. porrinensis (e altre specie di Amanita americane); per il Genere Galerina: G. marginata, G. autmnalis, G. venenata, ecc.; per il Genere Conocybe: C. filaris e probabilmente altre specie; per il Genere Lepiota: L. helveola, L. lilacea, L. subincarnata (= L. josserandii), L. brunneoincarnata, ecc.. Segnalata, ma ancora non confermata, la presenza di amatossine in Lepiota cristata.
Per le dimensioni, sono i funghi del Genere Amanita quelli ad essere più frequentemente responsabili di questa grave intossicazione, anche perché, con la loro ingestione, più facilmente si raggiungono dosaggi elevati di amanitine.
La gravità della sindrome falloidea è dovuta alla lunga latenza, che non consente un’immediata terapia finalizzata all’eliminazione dal tubo gastroenterico delle sostanze tossiche ingerite. Considerato che questa sindrome è frequentemente imputabile al consumo di Amanita phalloides, analizzeremo: la patogenesi, la cinetica, le caratteristiche cliniche, gli indicatori prognostici e le strategie terapeutiche dell’insufficienza epatica acuta conseguenti al consumo di questa entità fungina.
La tossicità dell’Amanita phalloides è legata a due distinti gruppi di tossine: fallotossine e amatossine.
Le fallotossine sono delle piccole proteine di solo 7 aminoacidi (eptapeptidi) falloina, fallolisina, fallacina, fallacidina, fallisicina. Queste tossine causano danni alla membrana degli enterociti e sono quindi responsabili dei primi sintomi gastrointestinali. Anche le fallotossine sono altamente tossiche per le cellule epatiche, ma aggiungono poco alla tossicità dell’Amanita phalloides in quanto non vengono assorbite dall’intestino e quindi non raggiungono il fegato.
 Le amatossine (il termine è generico) sono degli octapeptidi biciclici, formati da almeno 9 differenti composti: α-, β-, γ- ed ε-amanitina, amanullina, acido amanullinico, proamanullina, amanina, amanitidina. Fra tutte le amatossine l’α-amanitina è il composto principale e con la β-amanitina è probabilmente responsabile dell’effetto tossico.
Le amatossine (il termine è generico) sono degli octapeptidi biciclici, formati da almeno 9 differenti composti: α-, β-, γ- ed ε-amanitina, amanullina, acido amanullinico, proamanullina, amanina, amanitidina. Fra tutte le amatossine l’α-amanitina è il composto principale e con la β-amanitina è probabilmente responsabile dell’effetto tossico.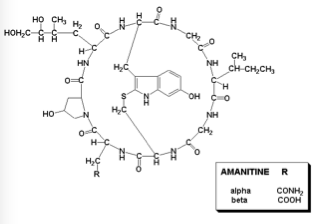
Alpha amanitina
La concentrazione di amatossine è variabile secondo la specie fungina interessata, secondo la parte di uno stesso sporoforo (il cappello o il gambo) e dipende dalle condizioni ambientali come per esempio il substrato, il periodo di crescita e le condizioni atmosferiche.
Le virotossine: alaviroidina, viroisina, dexoviroisina, viroidina, dexoviroidina. Sono presenti solamente in Amanita virosa, sono di poca o nulla importanza clinica se ingerite in quanto largamente inattivate dagli enzimi gastrici.
L’Amanita phalloides, contiene un’elevata concentrazione di amatossine, ne è stata stimata una concentrazione variabile dai 2 ai 15 mg/g di fungo secco.
Secondo SPOERKE & RUMACK, 1994, le concentrazioni di amanitine nelle diverse specie tossiche è la seguente:
Amanita phalloides e Amanita verna: 1,4-6,8 mg/g di peso secco
Amanita virosa: 1,9-2,6 mg/g di peso secco
Lepiota brunneoincarnata: 1,3 mg/g di peso secco
Lepiota subincarnata (=Lepiota josserandii): 3,5 mg/g di peso secco.
La dose letale di amatossine nell’uomo è stata quantificata in 0,1 mg/Kg di peso corporeo. Considerando la concentrazione media di amatossine presente nel fungo si può affermare che è sufficiente un solo cappello di Amanita phalloides, pari a circa 20 g, per determinare un’intossicazione letale. Emblematico è il caso dell’intossicazione avvenuta in un bambino di 2 anni solo … per aver leccato un cucchiaio di legno sporco di risotto con i funghi!
Le amatossine, termostabili, sono rapidamente assorbite attraverso l’epitelio intestinale, raggiungono il fegato che così risulta essere il primo organo sottoposto all’azione venefica delle tossine. Una volta nel fegato, le amatossine vengono veicolate da un sistema di trasporto aspecifico negli epatociti, producendo una vasta necrosi zonale centrolobulare e perivenulare che rispetta gli epatociti periferici e non altera sostanzialmente l’impalcatura strutturale del lobulo, permettendo la guarigione, con ripresa funzionale del fegato, nei casi di intossicazione meno severa. Invece nei casi più gravi, che presentano una fase epatica irreversibile, gli esiti possono essere il trapianto ortotopico del fegato o il decesso. Circa il 60% della dose di α-amanitina è secreta con la bile e viene restituita al fegato attraverso la circolazione enteroepatica.
Le amatossine si legano debolmente alle proteine del siero, non subiscono alcuna alterazione metabolica nell’organismo umano, persistono in circolo per circa 36 ore dall’ingestione, sono escrete, in forma attiva, con le urine in quantità discrete fino a 48 ore dall’ingestione ed in tracce entro le 72 ore, mentre nelle secrezioni biliari possono essere presenti anche dopo 5 giorni. Sono presenti nelle feci, entro le prime ore dal pasto fungino in elevata concentrazione, ma la loro presenza è da attribuirsi all’iniziale non assorbimento piuttosto che ad una reale secrezione. Vengono secrete nel latte materno, ma il loro passaggio transplacentare è ancora discusso (in una donna di 21 anni, incinta di 11 settimane, e con epatite tossica falloidea, il feto non subì alcuna conseguenza).
Per quanto riguarda il fegato le amatossine possono essere trovate anche dopo 20 giorni, e su prelievi da fegato di cadavere sono state trovate anche dopo 2 anni dal decesso; ciò indica un’elevata resistenza di queste tossine anche ai fenomeni di putrefazione.
Tuttavia altri organi, particolarmente il rene, sono sensibili alla loro tossicità. La loro eliminazione è, come già detto, principalmente urinaria ed in forma inalterata: la filtrazione glomerulare è limitata da una certa quota riassorbita a livello dei tubuli renali, con conseguente necrosi tubulare acuta. Infine, studi su animali e umani post mortem, hanno evidenziato danni cellulari al pancreas, alle ghiandole surrenali e ai testicoli.
Una volta penetrate nel nucleo degli epatociti, le amatossine interagiscono direttamente con l’enzima RNA polimerasi II inibendo la trascrizione e causando una progressiva riduzione dell’RNA messaggero (mRNA) con conseguente blocco della sintesi proteica. Per questa ragione i tessuti metabolicamente attivi, dipendenti da alti tassi di sintesi delle proteine, come le cellule del tratto gastrointestinale, epatociti e tubuli contorti prossimali del rene sono quelli più colpiti.
L’attività trascrizionale è fondamentale in qualsiasi cellula. La concentrazione di una proteina è generalmente controllata dalla velocità con la quale viene fabbricato l’mRNA che la codifica. Ne consegue che l’azione di blocco dell’RNA polimerasi di tipo II, da parte dell’α-amanitina, porta inevitabilmente a necrosi cellulare.
Sorprendentemente la tossina si lega sul lato posteriore dell’RNA polimerasi, lontano dal sito attivo e lontano dal sito di legame per il DNA e per l’RNA. Non blocca fisicamente il sito attivo, come la maggior parte degli inibitori, ma paralizza il meccanismo d’azione dell’enzima. La RNA polimerasi è un’enzima estremamente mobile che si piega e cambia forma mentre svolge le varie fasi della sua azione: legare il DNA, svolgerlo, e quindi costruire un nuovo filamento di RNA. La tossina si lega fra due subunità della proteina, incollandole insieme e bloccando questi movimenti essenziali.
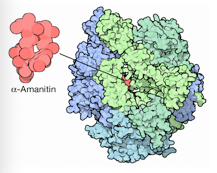
Tra gli altri possibili meccanismi tossici, è stato proposto che l’α-amanitina agirebbe in sinergia con alcune citochine endogene (ad esempio il Fattore di Necrosi Tumorale) e che questo potrebbe causare danni alle cellule attraverso l’induzione di apoptosi (processo di morte cellulare programmata).
Il quadro clinico è classicamente costituito di 4 fasi:
Fase di latenza. Poiché le tossine non sono di per sé irritanti la mucosa gastrointestinale, la fase iniziale è caratterizzata dall’assenza di segni o sintomi (a meno che non siano stati ingeriti contemporaneamente altri funghi tossici con breve latenza). Il periodo di latenza può variare dalle 6 alle 40 ore con una media di circa 10 ore. Purtroppo questa fase permette di consumare altri pasti successivi, aumentando così la quantità di amatossine ingerite con conseguente peggioramento della prognosi.
Fase gastrointestinale. Dopo molte ore (minimo 8 dall’ingestione del pasto tossico), inizia il quadro clinico in cui la fase gastroenterica precede obbligatoriamente la tipica e drammatica fase citotossica con interessamento epatico e renale. Stato di profondo malessere con epigastralgie crampiformi, vomito alimentare poi biliare spesso incoercibile, dolori addominali accompagnati da diarrea muco-sanguinolenta, talvolta coleriforme, sono l’espressione del già avvenuto assorbimento delle tossine fungine e del danno diretto alla mucosa gastroenterica. Tale situazione iniziale, a causa dell’imponente perdita idrica e deplezione elettrolitica, può portare, se non prontamente corretta, ad uno stato di shock ipovolemico con insufficienza renale acuta funzionale, prima ancora che abbia inizio la fase del danno epatico e renale. Crampi muscolari diffusi, obnubilamento del sensorio sono, in questa prima fase, i segni tipici della grave perdita di potassio. In questa fase in cui vi è una grave perdita di liquidi e disordini metabolici elettrolitici, potrebbe insorgere, quale complicanza, una sindrome rabdomiolitica che aggraverebbe ulteriormente il giudizio prognostico. I segni neurologici, come le convulsioni e le turbe del ritmo cardiaco con i sintomi dell’insufficienza cardio-circolatoria, sono da attribuire al grave squilibrio idroelettrolitico piuttosto che ad un’azione diretta delle tossine su tali organi ed apparati. A questo stadio della malattia i test di funzionalità epatica sono di solito normali.
Apparente convalescenza. Superata questa prima fase, detta anche dell’epatite anitterica, compare dopo circa 36-48 ore, la tipica sintomatologia caratterizzata dalla cito-necrosi epatica e dalle lesioni tubulari renali.
In questa fase, nonostante l’apparente miglioramento dei sintomi gastrointestinali, gli effetti delle tossine danneggiano sia il fegato che i reni, causando un progressivo deterioramento degli enzimi epatici con aumento delle transaminasi fino a superare 10.000 UI/L e della lattico deidrogenasi. L’intossicazione è più severa quando le alaninoaminotrasferasi (ALAT) superano 1.000 UI/L. All’inizio si ha una aumento delle transaminasi e della bilirubina e successivamente, fin dalla 48ª ora, riduzione della glicemia e dell’attività protrombinica. Nelle forme meno gravi si ha una lenta risoluzione, con un miglioramento dei sintomi confermato da una diminuzione degli enzimi (transaminasi) ed un aumento dell’attività protrombinica.
Insufficienza epatica acuta. In 4ª-5ª giornata si può osservare un ulteriore peggioramento testimoniato dalla persistenza di bassi valori di attività protrombinica e del fattore V di coagulazione, mentre le transaminasi possono talvolta anche diminuire, ma in questo caso sono indici di necrosi epatica massiva con prognosi infausta. L’entità della sintomatologia dipende dall’estensione della necrosi epatica, dalle condizioni generali del paziente e dalla suscettibilità individuale legata, secondo alcuni autori, alla presenza di un antagonista endogeno, l’antamanide.
L’acme è raggiunto intorno alla quarta giornata ed è seguito dalla remissione della sintomatologia, con restitutio ad integrum nel giro di circa due settimane, o dalla comparsa dei segni dell’insufficienza epatica grave. Marcata iperbilirubinemia, coagulopatia, encefalopatia epatica, sindrome epatorenale e spesso insufficienza pancreatica. Il decesso può sopraggiungere dopo 6-10 giorni.
La prognosi è legata alla gravità dell’epatite (mediamente circa 10% di mortalità). Il Centro Antiveleni di Milano riferisce invece solo un 1% di mortalità. Le maggiori percentuali di mortalità sono sicuramente da ascrivere ad una insufficiente o tardiva terapia. Essa non è correlata al valore delle transaminasi, ma alla presenza di fattori peggiorativi quali la giovane età (mortalità 2-3 volte più elevate nel bambino), i tassi del fattore V e la protrombina quando inferiore al 10%, l’insufficienza renale e l’encefalopatia.
La diagnosi è clinica. A conferma, è possibile oggi identificare l’α-amanitina urinaria con il metodo ELISA (Enzyme-Linked Immuno Sorbent Assay): sono sufficienti 1-2 ml di urina, prelevati precocemente e preferibilmente prima di iniziare il trattamento di reidratazione (al fine di evitare un’eccessiva diluizione dell’amanitina). Il limite di rilevamento del test è di 2 ng/ml di α-amanitina. Si considerano positivi valori soglia di amatossina urinaria >10 ng/ml.
Si deve precisare che il valore dell’amanitina urinaria non può essere considerato un indice prognostico, ma dipende dal tempo intercorso tra l’ingestione e il prelievo dell’urina, infatti più precoce è la misurazione del dosaggio tanto maggiore è il valore dosato, ciò significa che non esiste un rapporto tra la concentrazione di α-amanitina urinaria ed entità del danno epatico. Gli studi cinetici dell’α- e β-amanitina nell’uomo, hanno dimostrato che le amatossine sono presenti nel plasma a deboli concentrazioni, mentre a forti concentrazioni lo sono nelle urine e nelle feci (100 volte maggiori rispetto a al sangue), ma solamente durante le 24-48 ore susseguenti l’ingestione.
Per quanto riguarda la terapia, è di fondamentale importanza ai fini prognostici, un precoce intervento in reparto di emergenza (entro e non oltre le 30-36 ore dal pasto!) di diuresi forzata (1 litro ogni 10 kg di peso corporeo nelle 24 ore, più il reintegro delle perdite gastroenteriche) con sorveglianza dei parametri emodinamici ed elettrolitici (ogni 12 ore: glucosio, ALT, AST, AP, PTT, piastrine, urea, creatinina, elettroliti, bicarbonati, ematocrito, CPK; ogni 24 ore: bilirubina, calcio, magnesio, emogasanalisi, fattore V, se acidosi lattica valutare latticidemia; monitoraggio frequente: PA, PVC, output urinario, bilancio idroelettrolitico).
La diuresi forzata deve essere mantenuta fino a 72-96 ore dall’ingestione con progressiva riduzione dell’apporto di liquidi a partire dalla 4ª-5ª giornata. La diarrea, ricca di tossine, deve essere rispettata. La somministrazione ripetuta di carbone attivato (Carbomix® os grat sosp fl 50 g), eseguita per 3-4 giorni attraverso sondino nasogastrico fino a che perdura il vomito o per os. consente, legandosi alle amatossine, di impedire l’assorbimento oltre che bloccare il ricircolo enteroepatico.
Nelle intossicazioni da Amanita phalloides il Centro Antiveleni di Milano utilizza il seguente protocollo terapeutico:
Criteri di elevato sospetto per intossicazione da amatossina:
consumo di funghi non controllati;
sindrome gastroenterica insorta dopo almeno 6 ore dall’ingestione e non associabile ad eziologia infettiva o chirurgica;
danno epatico secondario a gastroenterite inteso come aumento di alcuni parametri di funzionalità epatica (INR > 1,1 e transaminasi > 50% della norma).
La presenza dei criteri elencati impone di espletare le seguenti indagini:
controllo basale, funzionalità epatica, renale, coagulazione, emocromo, elettroliti, glicemia;
amanitina urinaria (le urine, anche pochi ml, vanno raccolte assolutamente prima dell’idratazione);
controllo micologico su residui cotti o crudi, materiale biologico (vomito, aspirato gastrico);
Anche nell’impossibilità di praticare gli ultimi due punti, il paziente per il quale siano assoluti i criteri di elevato sospetto devono comunque iniziare il trattamento sotto riportato:
TERAPIA IN ACUTO IN PRONTO SOCCORSO

• Gastrolusi: utile anche se eseguita 12-18 ore dall’ingestione e in presenza di vomito spontaneo.
• Carbone vegetale attivato in polvere: in boli ripetuti, secondo tolleranza gastrica, ogni 4 ore fino a un totale di 1 g/Kg/die (se il vomito è persistente dopo la somministrazione tenere il sondino clampato per 15-20 minuti, quindi declampare e mantenere una lieve aspirazione fino alla somministrazione successiva).
• Solfato di magnesio: solo nell’adulto, unica somministrazione di 30 g per os insieme alla prima dose di carbone vegetale attivato (controindicato in caso di diarrea).
• Diuresi forzata: rappresenta il cardine del trattamento delle intossicazioni da amatossine e, se eseguita correttamente e tempestivamente, ha dimostrato di migliorare la prognosi di questa grave intossicazione.
Adulto: 1 litro ogni 10 Kg di peso corporeo, nelle 24 ore più il reintegro delle perdite gastroenteriche.
Bambino: 1,5 volte il fabbisogno idrico basale (calcolato in base all’età ed al peso), più il reintegro delle perdite.
Si consiglia l’uso di soluzioni idroelettrolitiche (ad es. glucosata al 5%, più sali in base al quadro elettrolitico).
• Target: output urinario (mantenuto con il carico idrico) 3-6 ml/Kg ora e B.I. pari; se presente insufficienza renale acuta, dopo reintegro delle perdite gastroenteriche, consultare un nefrologo per eventuale trattamento dialitico a sostegno della funzionalità renale.
Si consiglia posizionamento di catetere venoso centrale (CVC) nell’adulto per monitoraggio PVC, soprattutto in paziente con patologie cardiovascolari. Il CVC è necessario nel bambino solo in caso di disidratazione severa, shock, importante contrazione della diuresi (<1 ml/Kg/ora).
MONITORAGGIO IN REPARTO DI DEGENZA
Dall’ingresso in Pronto Soccorso monitorare ogni 2 ore:
- Glicemia, SGOT, SGPT, PT (INR), PTT, piastrine, azotemia, creatinina, elettroliti, Ht, CPK; e ogni 24 ore controllare: bilirubina, calcemia. magnesiemia, pH venoso, BE venoso, fattore V (se possibile).
- Se PT in progressivo calo, valutazione ematologica per screening coagulazione e terapia sostitutiva con vitamina K e plasma fresco o congelato.
- Se pH venoso in progressivo calo (<7,5) con BE >10 valutare latticidemia.
Nei bambini (0-14 anni), all’ingresso e nelle prime 72-96 ore, controllo quotidiano del peso corporeo per valutare lo stato di idratazione.
- < 5% disidratazione lieve
- 5-15% disidratazione moderata
- >15% disidratazione severa
Monitoraggio clinico: stato di coscienza, respiro e circolo.
TERAPIA IN REPARTO DI DEGENZA
Continuare con la diuresi forzata fino a 72-96 ore dall’ingestione con progressiva riduzione dell’apporto di liquidi a partire dalla 4ª-5ª giornata.
Monitorare PA, PVC, output urinario, bilancio idroelettrolitico.
N.B. l’uso del diuretico (furosemide) è previsto se, in presenza di B.I. positivo, la diuresi rimane <3 ml/Kg/ora e in caso di riscontro di segni clinici di sovraccarico idrico.
Carbone vegetale attivato per 3-4 giorni, attraverso sondino naso-gastrico fino a che perdura il vomito o attraverso somministrazione per os.
CONDOTTA CLINICA
- Se PT non diminuito per 5-7 giorni: rialimentazione.
- Se PT diminuito ma >30%, controlli seriati e ravvicinati dei parametri coagulativi.
- Se PT <30% e >10%, terapia sostitutiva per coagulopatia fino a PT >30%.
- Se progressivo peggioramento delle condizioni generali, degli indici di funzionalità epatica e della coagulazione, all’erta per trapianto di fegato.
CRITERI CLINICI PER IL TRAPIANTO
PT <10% difficilmente correggibile con sostituti plasmatici, eventualmente associato ad altri fattori prognostici peggiorativi: encefalopatia epatica, acidosi lattica, ipoglicemia severa.
CRITERIO DI DIMISSIBILITA’
Assoluta stabilità del PT.
Se il paziente viene dimesso con transaminasi ancora modestamente mosse, si consigliano: controlli ambulatoriali seriati e dieta per epatopatici.
Non è al momento disponibile alcun trattamento antidotico di cui sia stata dimostrata l’efficacia con studi clinici controllati. In relazione a ciò il CAV di Milano non utilizza e non consiglia alcuno schema terapeutico ad azione antidotica fra quelli riportati in letteratura.
L’impiego di N-acetilcisteina è stato recentemente abbandonato sulla base dell’esperienza maturata presso lo stesso Centro in accordo con i dati della letteratura.
Malgrado la progressiva riduzione dei tassi di mortalità registrata nel corso degli ultimi anni, la percentuale di decessi conseguenti al consumo di funghi contenenti amatossine si è mantenuta elevata, su valori compresi tra il 5 e il 10% dei casi trattati.
Numerose sostanze sono state usate (per alcune scuole lo sono tuttora) con valenza di antidoto nei confronti delle amatossine, ma non è al momento disponibile alcun trattamento antidotico di cui sia stata realmente dimostrata, per motivi etici, l’efficacia con studi clinici randomizzati.
La penicillina G è usata, in somministrazione venosa continua, alla dose di 1.000.000 UI/Kg per il primo giorno, quindi 500.000 UI/Kg per i due giorni successivi (tenendo conto che dosi massicce possono indurre degli effetti neurologici centrali soprattutto nei bambini). Il meccanismo d’azione ipotizzato sarebbe quello di inibire la fissazione delle amatossine sui recettori degli epatociti.
La silimarina(•) (Legalon® SIL, ev fl 10 mg/ml): viene impiegata in ragione di 5 mg/kg i.v. entro la prima ora, poi 20-50 mg/Kg i.v./die per i primi 3 giorni di terapia; sarebbe in grado di aumentare la stabilità della membrana epatocitaria impedendo l’ingresso delle amatossine.
Sebbene il trattamento combinato silibina/penicillina sia stato suggerito, non ci sono dati clinici a sostegno che questo approccio sia superiore alla monoterapia con silibina.
La somministrazione di N-acetilcisteina (Hidonac® ev 1 fl 5g/25 ml): 150 mg/Kg in 60 minuti, quindi 50 mg/Kg/4 ore per 48 ore, la cui efficacia deve essere ancora confermata, impedirebbe l’accumulo di metaboliti epatotossici.
Tuttavia, dato il lungo periodo di latenza tra ingestione dei funghi e comparsa dei sintomi, questi trattamenti farmacologici sono comunque tardivi e quindi non modificano la naturale evoluzione dell’intossicazione, in quanto le tossine sono già state captate dalle cellule epatiche.
Vi è in conclusione una generale concordanza nel ritenere che, al momento attuale, la terapia delle intossicazioni da funghi contenenti amatossine è basata essenzialmente sulla decontaminazione dello stomaco (gastrolusi, carbone vegetale attivato), sulla correzione dello stato di idratazione e di favorire, nelle prime ore dell’intossicazione, l’eliminazione renale delle tossine stesse.
In caso di insufficienza epatica grave, il trapianto epatico deve essere preso in considerazione, ma la difficoltà maggiore sta principalmente nel definire precocemente i fattori prognostici dell’irreversibilità delle lesioni epatiche.
Recentemente è stato sperimentato con successo (Lionte et al. – Rom J Gastroenterol. 2005 Sep.; 14(3):267-71) un nuovo approccio terapeutico attraverso un sistema di ricircolo epatico esterno per adsorbimento molecolare, denominato MARS (Molecular Adsorbent Recirculating System). Con tale sistema si è potuta salvare una donna di 39 anni con epatite fulminante per avvelenamento da Amanita phalloides per la quale non era disponibile il ricorso ad un trapianto epatico. Questo interessante metodo di depurazione epatico con l’utilizzo di un dialisato di albumina in grado di rimuovere quella parte di albumine legate alle tossine, se pur interessante, abbisogna di importanti nuove conferme.

(•)La maggiore componente della silimarina è la silibina o silibinina; estratta dal frutto del Silybum marianum, un’erbacea annuale o biennale, denominata volgarmente “cardo mariano”.
Per la capacità della silimarina di inibire il citocromo P450, sono possibili interazioni metaboliche con alcuni farmaci, tra cui: statine, warfarin, antidepressivi, antipsicotici, β-bloccanti, paracetamolo, isoniazide.
L’inibizione dell’UDPglucoronosiltrasferasi può alterare l’emivita di alcuni farmaci antitumorali.
L’inibizione dell’attività della glicoproteina-P interferisce con l’assorbimento della digossina e delle statine.
Riferimenti bibliografici:
Claudio Angelini “Le intossicazioni da funghi”; AMINT.
Roberto Galli “Le Amanite”; dalla Natura Editore.
Karl Kob “I funghi velenosi e le loro intossicazioni”; RdM, 2008, 3: 195-211.
Luca Santi et al. “Acute Liver Failure caused by Amanita phalloides poisoning”, 11 maggio 2012; Accademic Editor: Bruno Nardi.
P.M. Soave, A. Barelli, F. Cavaliere “Intossicazioni da funghi”; ANESTESIA FORUM 2009, 2; 109-123.
C. Locatelli, D. Maccarini, L. Manzo “Gli antidoti nel trattamento dell’intossicato”; EDUCATIONAL SYNOPSES IN ANESTHESIOLOGY and CRITICAL CARE MEDICINE, vol. 4 N° 4 aprile 1999.
Sindrome orellanica

La pericolosità di questa sindrome è stata scoperta a seguito di ripetuti avvelenamenti di massa avvenuti inizialmente in Polonia negli anni 1952, 1955 e 1957, dove il Cortinarius orellanus veniva venduto sui mercati di Varsavia, per un totale di quasi 200 intossicati e più di 30 decessi. Si deve al micologo polacco Staninslaw Gryzmala l’aver capito che l’ingestione di questa specie comportava l’insorgenza di una sindrome nefrocitotossica tristemente nota come “sindrome orellanica”. Gryzmala studiò approfonditamente il caso e riuscì persino ad isolare la tossina responsabile di questa sindrome che chiamò orellanina, la cui struttura chimica rimase sconosciuta sino alla metà degli anni ’70 quando i chimici polacchi Antkowiak e Gessner scoprirono che questa tossina apparteneva ad un gruppo di sostanze chimiche denominate bipiridine, una doppia struttura ad anello in cui entrambi gli anelli sono piridine (anelli eterociclici con un atomo di azoto). I due chimici scoprirono anche una sostanza simile, l’orellina che pur essendo affine dal punto di vista strutturale non è tossica.
Nella forma più stabile dell’orellanina gli atomi di azoto sono caricati positivamente, cosa che non avviene nell’orellina che, nella sua forma stabile è neutra.
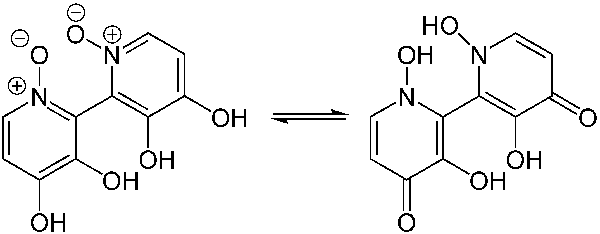
In Europa le specie responsabili di questa grave intossicazione sono due: Cortinarius orellanus e Cortinarius speciosissimus (= Cortinarius orellanoides). Per ragioni di completezza è doveroso rammentare che in letteratura sono descritte altre due specie di Cortinari contenti orellanina, ma non presenti nel nostro continente. Si tratta di Cortinarius ranierensis (Nord America) e Cortinarius fluorescens (Sud America).
In Italia la maggioranza di questi micetismi si sono verificati in Regioni (come il Trentino Alto Adige) dove esiste la diffusa abitudine alla raccolta di funghi appartenenti al Genere Chroogomphus, i quali presentano numerose affinità morfocromatiche. Proprio per questo motivo e considerata la scarsissima qualità organolettica di Chroogomphus helveticus e Chroogomphus rutilus, si sconsiglia vivamente la raccolta di queste due specie troppo simili in gioventù a Cortinarius orellanus e Cortinarius speciosissimus.
Dal punto di vista fisico l’orellanina ha una struttura cristallina che ricorda lo zucchero è inodore e termostabile. Non viene inattivata con l’essiccamento (presenta infatti una stabilità ambientale eccezionale e la sua tossicità rimane inalterata in campioni di funghi secchi di erbario vecchi anche di 60 anni!). Solo le altissime temperature (oltre 270 °C) e la luce ultravioletta trasformano l’orellanina in orellina, composto non tossico.
Si trova in maggiore concentrazione nel Cortinarius orellanus rispetto al Cortinarius speciosissimus. Cortinarius orellanus: 14 mg/g di peso secco;
Cortinarius speciosissimus: 9 mg/g di peso secco.
La DL50 ( dose letale media) nell’uomo è pari a 40-50 grammi di fungo fresco (Valli et al, 2002), ma sono sufficienti quantità minori per dare problemi renali.
Da studi condotti sugli animali da laboratorio, si è visto che l’orellanina non è dosabile nelle urine dopo 24 ore dalla somministrazione; ciò fa pensare che la tossina sia assorbita lentamente a livello dei tubuli renali rimanendo quindi a lungo in circolo.
L’organo bersaglio dell’orellanina è il rene ed il danno avviene per accumulo della tossina in fase di eliminazione renale.
Il suo meccanismo d’azione è di recente acquisizione: consisterebbe nel blocco totale dell’attività della fosfatasi alcalina (ALP) dell’orletto a spazzola delle cellule dei tubuli renali, interrompendo così la produzione di Adenosintrifosfato (ATP), indispensabile per il metabolismo cellulare, con conseguente necrosi cellulare.

Sezione di tubuli renali colorata con il metodo di Gomori per l’enzima fosfatasi alcalina; in questo modo viene evidenziato l’orletto a spazzola presente nella porzione apicale delle cellule epiteliali del tubulo convoluto prossimale. Il nucleo ed i citoplasmi (meno intensamente) sono colorati con Kernechtrot (rosso nucleare). (Fotografia del Dipartimento di Scienze della vita e Biologia dei sistemi, “Atlante di Citologia ed Istologia” – Università di Torino).
Il quadro clinico è classicamente costituito di 3 fasi:
Fase di latenza: La fase iniziale, piuttosto lunga, può andare dalle 7-9 ore fino a 2-3 giorni.
Fase gastroenterica: E’ caratterizzata da un lieve stato di malessere con inappetenza, nausea e senso di stanchezza generale. Possono anche comparire secchezza delle fauci con sete intensa, occasionali disturbi gastroenterici quali vomito e diarrea (seguita da stipsi ostinata), dolorabilità lombare ed epigastrica.
Si tratta di una fase transitoria cui segue un periodo di remissione di 8-10 giorni che può arrivare fino a 20 giorni!.
Fase renale: Dopo questa fase, che può anche mancare o sfuggire all’osservazione per la lieve sintomatologia, si manifesta l’insufficienza renale acuta caratterizzata da encefalopatia (conseguente all’iperazotemia), sete, sensazione di gusto metallico, brividi senza rialzo della temperatura, parestesie alle estremità, dolore lombare bilaterale, inizialmente poliuria, poi oliguria ed infine anuria. Le lesioni renali evolveranno quasi inevitabilmente verso un’insufficienza renale cronica irreversibile (sono rarissimi i casi di guarigione segnalati in questa fase).
L’insufficienza renale non è costantemente presente. La sua incidenza, a volte con oligo-anuria può variare dal 30 al 50%. Dipende dalla predisposizione individuale, da una nefropatia preesistente e dalla dose totale di tossine ingerite, come suggeriscono i dati sperimentali.
L’insufficienza renale compare dopo un ritardo spiegato dall’azione dell’orellanina nell’inibizione della biosintesi delle proteine nelle cellule tubulari.
L’esame istologico dimostra un quadro di nefrite interstiziale con necrosi tubulare diffusa, ostruzione tubulare da materiale necrotico, edema interstiziale, alterazioni glomerulari ischemiche con disintegrazione dei microvilli dell’orletto a spazzola e tendenza alla fibrosi interstiziale (Valli et al, 2002).
La diagnosi può essere difficile a causa di un tempo di latenza lungo fra l’ingestione e le prime manifestazioni cliniche; questo spazio di tempo eccezionalmente lungo per una sindrome micologica, rende possibile il ripetersi del consumo dei funghi in altri pasti. A differenza di altri micetismi, sono assenti lesioni epatiche.
Attualmente la diagnosi può essere confermata dall’individuazione dell’orellanina nel siero e nel tessuto renale. La tossina è individuabile nel sangue per almeno 10 giorni ma la liberazione di orellanina e dei suoi metaboliti, orellina ed orellinina, dalle cellule renali è molto lenta fino al sesto mese.
L’orellanina è una piccola molecola dializzabile ma si fissa precocemente nel tessuto renale, sicché il ruolo dell’emodialisi per depurare le tossine è probabilmente insignificante: prova ne sia che tale trattamento, effettuato in pazienti che avevano sicuramente consumato Cortinarius orellanus e che non avevano ancora manifestato sintomi, non ha impedito l’instaurarsi successivamente dell’insufficienza renale!.
La terapia è basata sul sostegno delle funzioni vitali e in particolare della funzione renale con la dialisi di supporto durante il periodo di sofferenza renale. La furosemide, potente diuretico dell’ansa, è da proscrivere in quanto si è dimostrato che aggrava le lesioni renali negli animali da laboratorio. Tecniche di depurazione come l’emoperfusione su colonna o la plasmaferesi non hanno dimostrato miglioramenti sull’evoluzione della patologia, così come l’uso di farmaci come ciclofosfamide e corticosteroidi. Non esiste trattamento antidotico specifico.
L’irreversibilità dell’insufficienza renale, obbliga il paziente che sopravvive alla fase acuta, ad una dialisi a vita o al trapianto renale quando possibile. In quest’ultimo caso, il trapianto deve essere realizzato tardivamente (6-30, mediamente 10 mesi, dopo il superamento della fase acuta!).
L’ipotesi di una patogenesi da radicali liberi rende plausibile l’impiego di glutatione (GSH) e/o di donatori di gruppi sulfidrilici (N-aceticlcisteina) utili alla ricostituzione del glutatione. Kilner et al riportano un caso trattato con steroidi, emodialisi ed infusione endovenosa con N-acetilcisteina, in cui la funzione renale migliorò, come di seguito meglio specificato.
Una donna di 67 anni, 10 giorni dopo aver consumato una minestra a base di Cortinarius orellanus, manifestò una insufficienza renale con valori di creatinina sierica pari a 1032 μmoli/L ed una concentrazione di urea nel sangue di 32,8 mmol/L.
La paziente venne sottoposta a trattamento dialitico e terapia corticosteroidea con prednisolone 60 mg una volta al giorno. Fu inoltre trattata con N-acetilcisteina per via endovenosa secondo la posologia standard per intossicazione da paracetamolo (150 mg/Kg in 15 minuti, poi 50 mg/Kg per 4 ore seguiti da 100 mg/Kg in 16 ore). La funzionalità renale migliorò dopo 7 giorni e divenne indipendente dalla dialisi dopo 17 giorni dall’ingestione dei funghi, con valori di uremia pari a 15,9 mmoli/L ed una creatinina di 449 μmoli/L. Fu dimessa dall’ospedale dopo 3 giorni con un percorso di riduzione del prednisolone, interrotto dopo 6 settimane. Dopo 2 mesi i valori di urea sierica e della creatininemia furono, rispettivamente, 9,5 mmoli/L e 168 μmoli/L.
In un’altra esperienza, Delphec N. et al riportano il caso di una donna di 31 anni ricoverata in ospedale 10 giorni dopo aver deliberatamente ingerito due carpofori di Cortinarius orellanus. Gli alti valori della creatininemia, pari a 1100 μmoli/L*, confermavano il grave quadro di insufficienza renale. La paziente è stata sottoposta a 6 sedute emodialitiche, una di plasmaferesi e alla somministrazione di Diltiazem ed aminoacidi.
Contemporaneamente Rapior S. et al hanno provveduto alla determinazione quantitativa dell’orellanina nei liquidi biologici e nel tessuto renale: per il dosaggio della tossina è stata utilizzata la tecnica cromatografica su strato sottile o TLC (acronimo della terminologia anglosassone Thin Layer Chromatography) con spettrofluorimetria, dopo fotodecomposizione specifica dell’orellanina in orellina. La concentrazione di orellanina nel plasma (10 giorni dopo
l’ingestione) è stata di 6,12 mg/L. I livelli di orellanina nel tessuto renale sono stati di 7 μg/25 mm3 nella prima biopsia
(13 giorni dopo l’ingestione) e 24 μg/8 mm3 nella seconda biopsia (6 mesi dopo l’ingestione).
18 mesi dopo il tentato suicidio, il livello plasmatico di creatinina era di 181 μmoli/L.
Il lungo periodo di latenza che caratterizza questa sindrome, non aiuta di certo il medico nella raccolta di tutti i dati anamnestici necessari. Difficilmente il paziente ricorderà o dirà di aver consumato funghi non controllati 15-18 o 20 giorni prima!. Ed in tal modo, così come è avvenuto in passato per altri micetismi (vedi per esempio “Sindrome norleucinica”), molti casi clinici di insufficienza renale acuta rimasti insoluti da un punto di vista eziologico, potrebbero
essere ascritti al consumo di funghi velenosi.
Anche in questo tipo di intossicazione la figura del micologo assume notevole un’importanza poiché, sia su funghi freschi oppure cotti o residui fungini, è possibile determinare qualitativamente l’orellanina con il test di Pöder al Cloruro ferrico (FeCl3).
Materiale occorrente:
• vetrino ad orologio;
• pipetta;
• acqua distillata;
• carta bibula (carta assorbente per laboratorio);
• reagente secondo Stahl 1967: [1 g di FeCl3 diluito in 49 ml di HCl 0,5 N (48 ml di H2O dist. + 2 ml di HCl al 37% m/m)].
Il reagente di Stahl così preparato è stabile per anni in boccettina ermeticamente chiusa.
Procedura:
si preleva un frammento di materiale fungino e si posiziona sul vetrino ad orologio, si aggiungono poche gocce di H2O dist. (un po’ di più se si tratta di fungo essiccato), si schiaccia il tutto in modo da produrre del liquido contenente succo cellulare. Si bagna una parte della carta bibula con il reagente di Stahl e si fa asciugare bene (utilizzando un phon ad aria bastano pochi minuti). Ora è possibile testare il liquido ottenuto dallo schiacciamento del frammento fungino: si preleva con la pipetta una piccola quantità di detto liquido, cercando di prelevare meno possibilmente i residui di materiale fungino (per evitare ciò si dovrebbe centrifugare o filtrare il preparato) e si fanno cadere due gocce sulla carta bibula, una dove c’è il reagente e l’altra dove non c’è reagente (quest’ultima serve come prova in bianco). La reazione si considera positiva se la zona centrale (dove viene lasciata cadere la goccia) si colora di bruno-viola con alone periferico lilla-violaceo. Per valutare al meglio la reazione il test dovrà essere effettuato su una specie di Cortinarius non contenente orellanina e, per testare la qualità del reagente, su un campione già identificato di Cortinarius orellanus o Cortinarius speciosissimus.
A – Reazione postiva di Cortinarius speciosissimus su carta bibula imbevuta del reagente secondo Sthal (colorazione bruno-violacea con alone lilla-violaceo).
B – Cortinarius speciosissimus su carta bibula senza reagente: si noti la presenza di particelle ocracee del fungo dove è caduta la goccia.
C – Reazione negativa di Cortinarius sp. su carta bibula imbrevuta di reagente: non è presente alcuna tonalità bruno-violacea.
D – Cortinarius sp. su carta bibula senza reagente.
*Per chi vuole trasformare i valori di creatininemia in mg/dl è sufficiente moltiplicare la concentrazione espressa in μmoli/L per 0,0113 (PM Creatinina = 113). Sicché una concentrazione di creatinina plasmatica pari a 150 μmoli/L
corrisponde a 1,695 mg/dl (150 • 0.0113 = 1,695). Si ricorda che la maggior parte dei laboratori considera come limite superiore della normalità un valore creatininemico di 1,3-1,4 mg/dl (115-124 μmoli/L ); esiste inoltre un rapporto inverso tra il livello della creatininemia e la funzionalità renale (tanto più alta è la creatininemia, tanto più ridotta sarà la funzione renale).
Riferimenti bibliografici:
• Marco Della Maggiora MicoPonte n. 1 – 2007.
• Claudio Angelini “Le intossicazioni da funghi”, AMINT.
• Pietro Curti “Tutto funghi”, AMINT – Giunti Demetra Editore, Firenze.
• Prast H. et al, Arch. Toxicol 1998 Ago; 62 (1): 81-8.
• Anna Aldrighetti, Margherita Gulino “Funghi: quali pericoli per il consumatore”, rapporto sull’attività svolta dagli Ispettorati Micologici delle SIAN nel quinquennio 2005-2009.
• P.M. Soave, A. Barelli, F. Cavaliere “Intossicazione da funghi”, ANESTESIA FORUM 2009; 2, 109-123.
• C. Duvic et al “Insuffisance rènale aigue après ingestion de Cortinarius orellanus chez 12 patients. Presentation
initiale et èvolution sur une pèriode de treize annue”, Press Med 2003; 32: 249-53 Masson, Paris.
• Rachael G. Kilner et al “Acute renal failure from intoxication by Cortinarius orellanus: recovery using antioxidant therapy and steroids”, Nephrology Dialysis Transplantation 1999; 14: 2779-80.
• Delphec N. et al “Outcome of renal failure caused by voluntary ingestion of Cortinarius orellanus”, Press Med 1990 Jan, 19 (3): 122-4.
• Rapior S. et al “Intoxication by Cortinarius orellanus detection and assay of orellanine in biological fluids and renal biopsies” Mycopathol. 1989 Dec; 108 (3): 155-61.
• Marco Donini ”Una subdola intossicazione”, Bollettino del Gruppo Micologico G. Bresadola – BGMB 46 (3): 5-12: 2004.
Sindrome norleucinica (proxima, smithiana)

La sindrome proxima è stata descritta per la prima volta nel 1994, nella Regione di Montpellier (Sud della Francia), in cinque pazienti che presentarono un’insufficienza renale acuta dopo ingestione di Amanita proxima, (Leray H., Canaud B., Andary C. et al. Amanita proxima poisoning: A new cause of acute renal insufficiency. Néphrologic 1998; 19: 21-4). Tutti i casi furono caratterizzati da una iniziale sintomatologia gastrointestinale, seguita da segni di citolisi epatica e da insufficienza renale acuta ed ebbero esito favorevole, senza evidenza di epatite o di danno renale cronico tre settimane dopo l’ingestione. Quattro pazienti richiesero un trattamento emodialitico temporaneo.
Successivamente sono stati segnalati (Pellizzari & Moser, Pagine di micologia, n° 11, 1999) altri casi soprattutto nella costa pacifica dell’America settentrionale riguardanti Amanite del Sottogenere Lepidella, principalmente Amanita smithiana e Amanita solitaria.
I quadri clinici assomigliano alla sindrome orellanica, a causa di un’elevata tossicità renale, ma mai si era potuto isolare orellanina.
Già negli anni fra il ’66 e il ’73, da questa Amanita era stato isolato un aminoacido allenico e non proteico termostabile, la norleucina allenica (acido 2-aminoesanoico), di cui si era dimostrata sperimentalmente la tossicità negli animali da laboratorio. Recentemente è stata isolata la clorocrotilglicina.
Allo stato attuale si è correlato questo aminoacido con questi casi di intossicazione umana e se ne è anche dimostrata sperimentalmente la notevole differenza di effetti tossici sulle cellule tubulari renali rispetto all’orellanina: l’orellanina blocca l’attività della fosfatasi alcalina (ALP) dell’orletto a spazzola delle cellule dei tubuli renali, la norleucina no. Questo fatto spiegherebbe la reversibilità del danno renale in questa sindrome rispetto alla irreversibilità che di norma avviene in quella orellanica.
Anche in Estremo Oriente altri studiosi giapponesi isolarono la norleucina allenica in alcune Amanite dello stesso gruppo (A. pseudoporphyria e A. neoovoidea), senza però confermare la tossicità.
Recentemente anche in Italia si sono moltiplicate le segnalazioni di sindromi norleuciniche, particolarmente nell’Italia centro-meridionale, dove più sono diffuse le Amanite di questo gruppo e dove sovente vengono tradizionalmente consumate. Le segnalazioni provengono soprattutto dalla Toscana, Puglia e Sardegna. Funghi responsabili di questa sindrome sono: Amanita ovoidea, A. proxima e A. aminoaliphatica.
Solo recentemente in Italia (2002) queste specie fungine sono stata inserite fra quelle tossiche riportate nelle normative regionali per la raccolta e commercializzazione dei funghi.
La sintomatologia esordisce mediamente dopo 12 ore dal pasto con vomito e, più raramente diarrea. Già in questa fase possono manifestarsi i segni di una moderata citolisi epatica, con incremento delle transaminasi sieriche (che raramente superano di dieci volte i valori normali). A partire dalle successive 24-48 ore compare il quadro dell’insufficienza renale acuta (malessere generale, oligoanuria, incremento dell’azoto ureico e della creatinina plasmatica); nel 25% dei casi è necessario il trattamento emodialitico, ma il recupero della funzionalità renale è la norma poiché non sono mai stati descritti casi di evoluzione in insufficienza renale cronica.
Questa sindrome si differenzia da quella orellanica per la presenza di un interessamento epatico e perché le alterazioni della funzione renale sono più precoci (1-4 giorni contro 15-17) e solo temporanee.
La terapia comprende la gastrolusi, carbone attivo ed il sostegno delle funzioni vitali. In presenza di grave insufficienza renale è necessario il trattamento dialitico (Warden CR, Benjamin DR. Acute renal failure associated with suspected Amanita smithiana ingestions: A case series. Acad Emerg Med 1998; 5:808-12). Anche in questa sindrome (come in quella orellanica e giromitrica) esiste un’importante variabilità individuale della sensibilità agli effetti della specie fungina responsabile, viene pertanto suggerito di valutare la creatinina plasmatica in tutti i commensali anche se asintomatici.
Riferimenti bibliografici:
• P.M. Soave, A. Barelli, F. Cavaliere “Intossicazioni da funghi” ANESTESIA FORUM 2009, 2; 109-123.
• Claudio Angelini “Le intossicazioni da funghi”, AMINT.
Sindrome acromelalgica (eritromelalgica)

Clitocybe amoenolens
Nonostante sia stata descritta nel 1918 da Ichimura (Ichimura T. A new poisonus mushroom. Bot Gaz Tokyo 1918; 63: 109-11), questa sindrome è passata inosservata fino ad oggi per il fatto che l’unica specie ritenuta responsabile, Clitovcybe acromelalga (volgarmente chiamato fungo delle ustioni o fungo tossico del bambù), è rinvenibile solo in Estremo Oriente con casi di avvelenamento registrati in Giappone e Corea del Sud.
Da pochi anni non è più così perché si sono verificate casi di intossicazioni di questo tipo nel Sud della Francia e più precisamente a Lanslebourg a ridosso dell’Alta Savoia nel 2001 (Saviuc PF, Danel VC, Moreau PA, et al. Erythromelalgia and muschrooms poisoning, J Toxicol Clin Toxicol 2001; 39: 403-7), dopo ingestione di Clitocybe amoeneolens.
Successivamente in Italia, nel 2002, si è registrato un avvelenamento collettivo (8 persone) ad Avezzano (AQ) (Leonardi et al., 2002; Brunelli, 2006).
I casi europei sono da imputare all’ingestione di Clitocybe amoenolens, specie abbastanza comune, ritenuta tossica già in precedenza ma i cui effetti non erano ancora stati studiati a sufficienza.
Nella casistica francese e italiana, tutti i pazienti hanno presentato forti dolori di tipo urente alle estremità dei piedi e, a volte, anche delle mani, o di tipo “scossa elettrica” o “punture di spillo”, in rari casi anche a livello dei talloni, della punta del naso e delle orecchie. Tali dolori avvengono per forti crisi parossistiche soprattutto notturne, ma in alcuni casi anche diurne, con frequenza di una crisi ogni 30 minuti.
In corrispondenza delle zone doloranti si ha sempre la presenza di un edema grave che, nei momenti parossistici, si associa ad eritema ed aumento della temperatura al termotatto nelle aree medesime. I sintomi si acuiscono con l’esposizione delle estremità a fonti di calore, con l’ortostatismo prolungato e con la deambulazione e, di nonverso, si attenuano con il raffreddamento ed il sollevamento delle estremità.
Non sono presenti sintomi gastroenterici né segni di citolisi epatica.

Clitocybe acromelalga
Le tossine responsabili, isolate da Clitocybe acromelalga, sono degli acidi acromelici (A-B-C-D-E); con un sistema combinato di cromatografia liquida e spettrometria di massa, molto sensibile è possibile determinare la concentrazione dell’acido acromelico A, anche in Clitocybe amoenolens (Bessard et al., 2004).
Gli acidi acromelici, idrosolubili e termostabili, strutturalmente simili all’acido kainico e domoico (neuromediatori eccitatori fisologici), sarebbero responsabili dell’iperemia e della reazione infiammatoria alle estremità ed agirebbero attivando i recettori glutammatergici periferici, quindi si pensa che queste tossine non passino la barriera ematoencefalica ed esplichino la loro azione sulle terminazioni nervose periferiche, con un danno elettivo a carico delle vie della sensibilità (fibre poco o non mielinizzate del Sistema Nervoso Autonomo).
Il meccanismo d’azione non è ancora stato pienamente chiarito, ma il quadro clinico è sovrapponibile all’eritromelalgia transitoria da farmaci [bromocriptina (Parlodel), verapamil (Isoptin), nifedipina (Adalat)] in cui è stata documentata una flogosi del derma con infiltrazione mononucleare perivascolare.
Il quadro clinico, che compare a distanza di 1-3 giorni dall’ingestione, è caratterizzato da algoparestesie delle estremità, soprattutto dei piedi (formicolio, dolore intenso, percezioni termiche alterate), che possono essere accompagnate da eritema, edema e formazione di vescicole.
I sintomi, che possono persistere per molti giorni o alcuni mesi, sono caratterizzati da crisi parossistiche, principalmente notturne, stimolate dal contatto e dal calore.
La terapia è sintomatica ed è basata sull’impiego di FANS ed oppioidi. Può essere utile il ricorso a farmaci efficaci sul dolore neuropatico come clonazepam (Rivotril® 2,5 mg/mL os 10 mL), imipramina (Anafranil® 25 mg cpr riv) e carbamazepina (Tegretol® 200 mg cpr). E’ utile il riposo e l’evitare contatti cutanei, sfregamenti ed esposizione a fonti di calore. Bagni prolungati in acqua fredda mitigano il dolore.
Riferimenti bibliografici:
- Marco Della Maggiora “Gli avvelenamenti da funghi”, MicoPonte 1 – 2007: 24-40.
- P.M. Soave, A. Barelli, F. Cavaliere “Intossicazioni da funghi”, ANESTESIA FORUM 2009; 2:
109-123.
• Anna Aldrighetti, Margherita Gulino “Funghi: quali pericoli per il consumatore”, rapporto
sull’attività svolta dagli Ispettorati Micologici delle SIAN nel quinquennio 2005-2009. • Claudio Angelini “Le inrtossicazioni da funghi”, AMINT.
Sindrome rabdomiolitica

Tricholoma equestre
Si tratta di una sindrome di recentissima acquisizione studiata in Francia per una serie di avvelenamenti avvenuti dal 1992 al 2000.
Tutto ebbe inizio il 13 settembre 2001 con una pubblicazione sulla prestigiosa rivista scientifica “The New England Journal of Medicine” per mano di un gruppo di ricercatori dell’Università di Bordeaux (Francia).
In questo lavoro veniva documentata l’insorgenza di una grave rabdomiolisi* in 12 persone, 5 uomini e 7 donne, di età compresa tra i 22 e i 60 anni, 3 delle quali decedute, che avevano in comune il fatto di aver consumato il Tricholoma equestre in almeno 3 pasti ravvicinati.
Gli esemplari sotto accusa erano stati raccolti sul terreno sabbioso nelle pinete della costa Atlantica del sud-ovest della Francia e i 12 casi non erano in contemporanea, ma datati dal 1992 al 2000 (Cherubini, 2002).
Dal punto di vista sintomatologico tutti i pazienti svilupparono astenia, affaticamento muscolare e mialgia prossimale 24-72 ore dopo l’ingestione di un fungo giallo chiamato Tricholoma equestre (Bedry R., Baudrimont I., Deffieux G. et al. Wilde mushroom intoxication as a cause of rhabdomyolysis. N Eng J Med 2001; 345: 798-02). Nei quattro giorni successivi presentarono tutti un peggioramento dell’astenia muscolare, specialmente a livello dei muscoli quadricipiti, eritema facciale, nausea senza vomito, diaforesi senza febbre e danno renale con urine ipercromiche (mioglobinuria). Inoltre erano presenti i segni di una grave rabdomiolisi, con un valore medio di picco massimo degli enzimi muscolari (CK) di oltre 22000 U/L nelle donne e 34000 U/L negli uomini. L’elettromiografia confermava la presenza del danno muscolare, senza evidenziare concomitanti alterazioni dei nervi periferici.
3 pazienti morirono in rianimazione dopo aver sviluppato una forma di miocardite acuta con ipertermia (fino a 42 °C) e dispnea.
L’esame istologico (dopo autopsia) dimostrò una necrosi dei muscoli striati del diaframma e del miocardio, lesioni renali e nessuna lesione epatica.
Gli altri 9 pazienti presentarono una normalizzazione dei valori di CK sieriche in 2 settimane, ma continuarono ad accusare astenia per diverse settimane ancora.
Nel 2002 sono stati segnalati 2 casi in Polonia (madre e figlio) conseguenti a 9 pasti consecutivi di Tricholoma equestre, dichiarati fuori pericolo dopo ben 23 giorni di ricovero (Brunelli, 2006).
A Taiwan, nel 2001, sono stati riportati casi di rabdomiolisi per ingestione di funghi appartenenti alla specie Russula subnigricans.

Russula subnigricans
In Italia non sono mai stati registrati casi analoghi, ma a seguito dell’accaduto, il 20 agosto 2002, il Ministero della Salute ha disposto, con Decreto Ministeriale, il divieto di raccolta, distribuzione e vendita di questa specie (Tofani, 2003).
La tossina responsabile dell’intossicazione è ancora sconosciuta. Nessuno dei principi attivi isolati dal fungo ha riprodotto da solo, il quadro clinico dell’avvelenamento negli animali da esperimento. L’estratto intero determina invece delle alterazioni degenerative e necrotiche a carico delle fibre muscolari striate, comprese quelle cardiache.
In base ad una ipotesi degli Autori dell’articolo, “potrebbe essere una suscettibilità muscolare di origine genetica, smascherata da una sostanza tossica contenuta nel Tricholoma equestre quando la quantità ingerita superata certi limiti, ad originare la miopatia”.
Pur trattandosi di un’evenienza piuttosto rara, è bene che il medico tenga presente che nell’eziologia di una rabdomiolisi (ad esempio: gravi traumi in persone schiacciate sotto le macerie e per molto tempo come avviene nei terremoti, per malattie immunitarie, nel corso di particolari infezioni batteriche e virali, da combinazione con alcuni farmaci ipocolesterolemizzanti, come le “statine”) anche una responsabilità fungina è da tenere in debito conto nella diagnosi differenziale. La terapia è basata sul sostegno delle funzioni vitali e sul reintegro delle perdite idroelettrolitiche; non esiste alcun antidoto. La diuresi forzata alcalina e le metodiche invasive di depurazione (emofiltrazione, emodialisi) sono finalizzate ad accelerare la rimozione della mioglobina e sostenere la funzione renale (Chodorowski Z., Waldman W., Sein Anand J. Acute poisoning with Tricholoma equestre. Przegl Lek 2002; 59: 3867).
Qualunque soggetto che manifesti stanchezza e debolezza muscolare dopo aver consumato funghi gialli negli ultimi giorni, deve essere ricoverato per il monitoraggio degli enzimi muscolari.
*La rabdomiolisi è una grave evenienza clinica dovuta a distruzione o a lesioni a carico delle fibre muscolari striate (lesioni con rottura del sarcolemma e successiva fuoriuscita di enzimi, mioglobina ed altre sostanze).
Riferimenti bibliografici:
- Marco Della Maggiora “Gli avvelenamenti da funghi”, MicoPonte 1 – 2007: 24-40.
- P.M. Soave, A Barelli, F. Cavaliere “Intossicazioni da funghi”, ANESTESIA FORUM 2009; 2: 109-123.
-
Claudio Angelini “Le intossicazioni da funghi”, AMINT.
Sindrome di Szechwan

Questa sindrome tossica, caratterizzata da emorragie e porpore emorragiche, si è sviluppata negli Stati Uniti tra il 1970 e il 1980 in seguito al consumo ripetuto di alcuni piatti tipici della cucina cinese.
Ingestioni spropositate di una di queste pietanze, il mio po tofu, a base di fagioli, latte cagliato e Auricularia polytricha (= Hirneola polytricha), comportava l’insorgenza di un quadro clinico caratterizzato da fenomeni emorragici più o meno gravi, quali: epistassi, menorragia, sanguinamenti gengivali e porpore emorragiche in soggetti che abitualmente consumavano questo fungo.
Pur essendo stata descritta per la prima volta nel 1980 da un ematologo del Minnesota (USA), tale Dott. Hammerschmidt, questa sindrome non compare nei testi classici di micotossicologia (eccezion fatta per il libro di D. Benjiamin del 1995) per cui risulta pressoché sconosciuta alla gran parte dei micologi e alla quasi totalità dei medici.
Si deve all’ematologo statunitense, l’aver correlato questo nuovo micetismo con l’ingestione di alcune specie del Genere Auricularia, tra le quali anche Auricularia auricula-judae e Auricularia porphyrea, entità fungine ampiamente coltivate e consumate nella provincia cinese dello Szechwan.
 Il Dott. Hammerschmidt, aveva notato tra i suoi pazienti un numero troppo elevato di misteriose emorragie e/o porpore emorragiche. La ricerca eziologica aveva infatti escluso quelle rare affezioni dovute a difetti genetici e quelle provocate da farmaci ad attività antiaggregante piastrinica, quali: Warfarin, Aspirina, FANS, ecc.. Finì col constatare che parecchi dei suoi clienti erano abituali e fanatici consumatori di una “discutibile” preparazione cinese acquistabile anche nei supermercati, il mio po tofu appunto, a base dei funghi incriminati.
Il Dott. Hammerschmidt, aveva notato tra i suoi pazienti un numero troppo elevato di misteriose emorragie e/o porpore emorragiche. La ricerca eziologica aveva infatti escluso quelle rare affezioni dovute a difetti genetici e quelle provocate da farmaci ad attività antiaggregante piastrinica, quali: Warfarin, Aspirina, FANS, ecc.. Finì col constatare che parecchi dei suoi clienti erano abituali e fanatici consumatori di una “discutibile” preparazione cinese acquistabile anche nei supermercati, il mio po tofu appunto, a base dei funghi incriminati.
Tutte queste specie, se consumate troppo di frequente ed in quantità eccessive, o, peggio ancora, se abbinate ad aromi tipici della cucina cinese, quali lo zenzero, o ad antiaggreganti piastrinici, possono provocare alterazioni dei processi coagulativi.
I sintomi compaiono dopo circa 6 ore dal pasto e sono rappresentati, come già detto da: epistassi e/o sanguinamento cutaneo, oltre la norma per traumi superficiali; gli esami di laboratorio evidenziano un’aumentata resistenza all’aggregazione piastrinica.
Questi funghi, pertanto, non devono essere consumati prima di interventi chirurgici e in pazienti con difetti coagulativi.
La terapia è sintomatica e prevede l’impiego di vitamina K (Konakion® 10 mg/mL sol. orale e iniettabile); la prognosi, e solitamente fausta. Per il medico, questa sindrome deve essere tenuta in considerazione per la diagnosi differenziale con altre porpore emorragiche.
Riferimenti bibliografici:
• Claudio Angelini “Le intossicazioni da funghi”, AMINT.
Sindrome encefalopatica

Pleurocybella porrigens
E’ stata segnalata di recente in Giappone per il consumo di Pleurocybella porrigens in soggetti che soffrono di insufficienza renale cronica, ipotizzando che le tossine agiscano all’interno di un quadro di nefropatia pregressa ed i cui sintomi sintomi si manifestano dopo 6 ore o più dall’ingestione.
La sindrome è caratterizzata, dopo una latenza di circa 2-3 settimane, dalla comparsa di una encefalopatia convulsiva (lesioni edematose plurifocali).
Pleurocybella porrigens è uno dei funghi più comuni e popolari in Giappone ed è anche coltivato su scala industriale in strutture dedicate. Il fungo, chiamato in Giappone “Sugihiratake” e nei paesi anglosassoni “fungo ad ala d’angelo”, è un basidiomicete che si sviluppa saprofito su rami o tronchi morti di Abies alba e Picea abies.
Alcuni testi di micologia definiscono il fungo come commestibile, di sapore grato, sia pure con un retrogusto di ago di abete.
Ad oggi sono stati registrati 46 casi di encefalopatia da Pleurocybella porrigens.
La maggior parte dei pazienti coinvolti presentava una insufficienza renale ed era cronicamente sottoposta a trattamento emodialitico.
I pazienti intossicati presentavano lievi prodromi, quali malessere generale, difficoltà di deambulazione e tremori, senza sintomi gastrointestinali (nausea, vomito o diarrea). Tali sfumati sintomi erano seguiti a distanza di alcuni giorni da disturbi più marcati della coscienza e convulsioni intrattabili. Esami del liquido cefalorachidiano hanno mostrato livelli elevati di proteine senza pleiocitosi (aumento del numero di leucociti nel liquor). Dai 3 agli 8 giorni dopo l’esordio, le immagini del cervello hanno rilevato evidenti lesioni diffuse nella corteccia cerebrale. Il decesso avveniva dopo circa 10 giorni dalla comparsa delle crisi epilettiche.
Nei pazienti non si sono osservati segni o sintomi encefalici da infezione batterica o virale quali febbre, mal di testa o rigor nucale. In circa la metà dei pazienti si è dovuto ricorrere a intubazione endotracheale e a ventilazione meccanica per deficit respiratorio da sedazione e impiego di farmaci miorilassanti, richiesti dalla grave crisi epilettica.
I decessi registrati sono stati complessivamente 15, avvenuti in genere da una settimana ad un mese dall’inizio della sintomatologia.
Nel 2009, ci fu un ulteriore rapporto di una morte in Giappone legata sempre al consumo di questa specie che ha visto coinvolto un uomo di 65 anni in trattamento emodialitico da tre mesi. L’esame istologico del cervello ha rilevato un’ampia zona necrotica postinfartuale nella corteccia cerebrale profonda e cerebellare.
Sono state avanzate diverse teorie per poter spiegare la comparsa di questa grave sindrome.
Si è ipotizzato, ad esempio, che il fungo abbia subito una mutazione genetica, verosimilmente legata a fattori ambientali e atmosferici, con conseguente produzione di sostanze tossiche che non verrebbero eliminate con le urine (tutti i soggetti coinvolti erano nefropatici), producendo un effetto tossico da accumulo.
Per chiarire ancora meglio il rapporto tra i casi di encefalopatia e questo fungo è stata condotta un’analisi multivariata dei metaboliti in esemplari di Pleurocybella porrigens “probabilmente tossici” raccolti nelle zone dove si sono sviluppati focolai di encefalopatia ed esemplari “probabilmente sicuri” raccolti in zone dove la sindrome non si è manifestata.
Questo studio ha dimostrato che in esemplari di Pleurocybella porrigens, raccolti nei distretti in cui si sono manifestati i casi di intossicazione, vi è un’alta concentrazione di metaboliti della vitamina D. Tali sostanze, agonisti o antagonisti della vitamina D, nei pazienti con insufficienza renale cronica si accumulerebbero nel sangue, sviluppando ipocalcemia o ipercalcemia, situazioni queste che potrebbero determinare una sindrome encefalica.
L’agente eziologico è stato a lungo un mistero, ma secondo un recente rapporto pubblicato su Angewandte Chemie International (Wakimoto T. et al. 2011) la tossina potrebbe essere un insolito aminoacido instabile chiamato Pleurocybellaziridine.
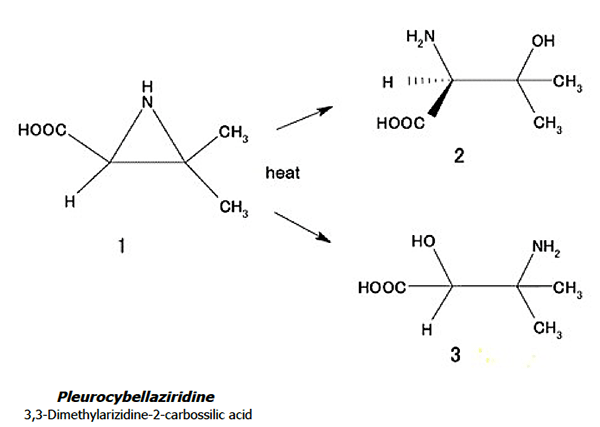
Questo composto è costituito da un anello triciclico con un gruppo imminico (=NH) all’apice, un atomo di carbonio cui sono legati due gruppi metilici (–CH3) e l’altro carbonio legato ad un atomo di idrogeno e ad un gruppo carbossilico (–COOH).
Se dovesse raggiungere il cervello, Pleurocybellaziridine potrebbe essere in grado di provocare i sintomi demielinizzanti osservati a seguito di oligodendrociti danneggiati.
Infatti, in prove sperimentali, effettuate utilizzando ratti CG4-16, questa tossina è in grado di superare la barriera ematoencefalica determinando necrosi oligodendrocitaria.
In Italia Pleurocybella porrigens è specie rara (descritta da Bresadola in Trentino) e non risulta essere consumata.
Riferimenti bibliografici:
• P. Franchina “Sindrome encefalica da Pleurocybella porrigens”; 4° Convegno Internazionale
di Micotossicologia, 6-7 dicembre 2007- Trento.
• Obara K. et al. Acute encephalopathy associated with ingestion of a mushroom,
Pleurocybella porrigens (Angel’s wing), in a patient with chronic renal failure.
• Sasaki H. et al. Sugihiratake mushroom (Angel’s wing mushroom) induced cryptogenic
encephalopathy may involve vitamin D analogues. Biological & pharmaceutical bulletin
29:12, 2006 Dec pg 2514-8.
• Wakimoto T. et al. Proof of the existence of an unstable aminoacid: Pleurocybellaziridine in
Pleurocybella porrigens. Angewandte Chemie International Edition ; 2011/01/02, pg. 1168.
Sindrome neurotossica tardiva

E’ una sindrome molto rara (ad oggi sono stati segnalati solo 3 casi di intossicazione), descritta in Germania alla fine degli anni ’90 ed è causata dal fungo Hapalopilus rutilans (Saviuc P, Flesh F. Acute higer fungi mushroom poisonin and his treatment. Presse Mediale 2003; 32:1427-35).
Il quadro clinico compare tardivamente, circa 12 ore dopo il pasto ed è caratterizzato da disturbi gastroenterici, urine color viola, compromissione del fegato e dei reni e segni a carico del Sistema Nervoso Centrale con capogiri, atassia, sonnolenza, agitazione e alterazioni del tracciato elettroencefalografico (EEG) compatibile con l’edema cerebrale.
 La tossina responsabile è l’acido poliporico, inibitore reversibile della diidroorotato deidrogenasi* (DHO-DH), capace di riprodurre la sindrome negli animali da esperimento (Kraft J, Bauer S, Keilhoff G, et al. Biological effects of the dihydroorotate dehydrogenase inibitor polyporic acid, a toxic costituent of the mushroom Hapalopilus rutilans, in rats and humans. Arch Toxicol 1998; 72: 711-21). Isolato per la prima volta nel 1877 da Johan Carl Friedrich Stahlschmidt dal fungo Hapalopilus nudilans, è presente in forti concentrazioni (40% del peso secco) nel fungo incriminato.
La tossina responsabile è l’acido poliporico, inibitore reversibile della diidroorotato deidrogenasi* (DHO-DH), capace di riprodurre la sindrome negli animali da esperimento (Kraft J, Bauer S, Keilhoff G, et al. Biological effects of the dihydroorotate dehydrogenase inibitor polyporic acid, a toxic costituent of the mushroom Hapalopilus rutilans, in rats and humans. Arch Toxicol 1998; 72: 711-21). Isolato per la prima volta nel 1877 da Johan Carl Friedrich Stahlschmidt dal fungo Hapalopilus nudilans, è presente in forti concentrazioni (40% del peso secco) nel fungo incriminato.
La terapia è finalizzata al sostegno delle funzioni vitali ed al reintegro idroelettrolitico; sono utili la gastrolusi entro 6 ore dall’ingestione e la somministrazione ripetuta di carbone attivato. Nel caso si instauri l’insufficienza renale, può essere necessario il trattamento emodialitico. Tutti e tre gli intossicati si ristabilirono completamente.
*E’ un enzima mitocondriale che svolge un ruolo chiave nella sintesi delle basi azotate pirimidiniche indispensabili per la replicazione del DNA.
Riferimenti bibliografici:
• P.M. Soave, A Barelli, F. Cavaliere “Intossicazioni da funghi”, ANESTESIA FORUM 2009; 2:
109-123.
• Caludio Angelini “Le intossicazioni da funghi”; AMINT.