La micologia è una branca delle scienze naturali che si occupa dello studio dei funghi. Il termine deriva dalle parole greche per fungo (múkes, μύκης) e scienza (lógos, λόγος)
Il campo di studio della micologia è l’intero regno dei funghi: dai macromiceti, che possono raggiungere ragguardevoli dimensioni, ai micromiceti, molto più numerosi dei primi ed infinitamente più piccoli.
Si tratta di una scienza in continua evoluzione, data la particolare collocazione dei funghi come esseri viventi (sono organismi con caratteristiche sia degli animali che dei vegetali).
In queste pagine noi tratteremo tutto ciò.
CIANOFILIA

Clitocybe nebularis
Con tale termine s’intende la capacità che hanno alcuni elementi fungini (parete sporale, ornamentazioni, parete delle ife) di assumere una tonalità azzurra se posti a contatto con alcuni coloranti quali il Blu cotone o Blu di metile.
Tali coloranti si possono fissare più o meno decisamente su queste strutture e, in base a tale peculiarità, è possibile distinguere le spore in:
• cianofile (quando la membrana si colora da blu a violetto; come ad esempio, nel Genere Entoloma);
• acianofile (quando la membrana non assume tale colorazione; come, ad esempio, nel Genere Tricholoma.
In buona sostanza si parla di reazione cianofila quando una parete (sporale o ifale) si colora assorbendo il Blu cotone mentre l’interno della spora o ifa rimane incolore. Anche alcune ornamentazioni, quali: verruche, aculei, creste possono essere cianofile, come ad esempio in numerose specie del Genere Ramaria, in Aleuria e Scutellina.
La formulazione del colorante varia a seconda che si operi su materiale fresco o d’erbario.
Blu cotone: andrà impiegato, in soluzione acquosa allo 0,1% su campioni freschi.
Per la sua preparazione si opera nel modo seguente:
sciogliere 50 mg di Blu cotone in polvere in 50 mL di acqua distillata. La soluzione è così pronta.
Blu lattico: si usa come la soluzione acquosa di Blu cotone. Può essere impiegato anche per il materiale d’erbario in quanto l’acido lattico è un rigonfiante.
Per la sua preparazione basta sciogliere 50 mg di Blu cotone in 30 mL di acido lattico, agitando energicamente. Lasciare riposare per 24 ore agitando ogni tanto. Filtrare.
Blu cotone in lattofenolo per exsiccatum.
Si usa una soluzione di Blu cotone al 5% in lattofenolo.
E’ sufficiente sciogliere 2,5 g di Blu cotone in polvere in 47,5 g di lattofenolo. Rispetto al Blu lattico ha un effetto più moderato e perciò migliore.
Blu tripano
A.- Soluzione secondo Clemençon, modificata secondo Erbe Matheis. 1. Acqua distillata: 80 mL;
2. KOH: 0,8 g;
3. NaCl: 0,8 g;
4. Invadin: 0,5 g;
5. Fenolo (C6H5OH) in cristalli: 0,5 g;
6. Blu tripano in polvere: 0,5 g;
7. Glicerina F.U. [CH2(OH)CH(OH)CH2(OH)]: 20 g.
B.- Soluzione secondo Dade
1. Soluzione acquosa di Blu tripano allo 0,2%: 50 mL; 2. Acido lattico F.U.[CH3CH(OH)COOH]: 100 g;
3. Fenolo: 100 g;
4. Glicerina F.U.: 150 mL;
5. Acqua distillata: 50 mL.
Modalità di preparazione:
A.- Mescolare nell’ordine indicato i reagenti da 1 a 5, quindi aggiungere il colorante e mescolare con nottolino su piastra magnetica per almeno 2 ore. Solo a questo punto versare la glicerina. Mescolare, attendere 24 ore ed infine filtrare.

B.- Preparare una soluzione acquosa del colorante sciogliendone 500 mg in 250 mL di acqua distillata.
Prelevarne 50 mL e miscelare con gli altri reattivi citati.
Il suo uso è particolarmente prezioso per colorare lo strato interno delle pareti ifali e di alcune spore.
Esecuzione del saggio:
Fare delle sottile fettine della parte che si vuole esaminare, collocarle su di un vetrino, mettere vicino una goccia di Blu lattico e farvi scivolare dentro le fettine.
Bisogna comunque considerare che anche se diluito il reagente risulta denso per cui richiede un lungo assorbimento, vi sono tre possibilità:
- 1. si attende un tempo variabile da 3 a 48 ore, in dipendenza della consistenza del fungo, poi si asciuga il residuo di Blu lattico, si aggiunge Cloralio idrato o L4, si copre con il coprioggetto e si osserva.
- 2. Si copre con il coprioggetto, si prende il vetrino con le pinzette per non rischiare di ustionarsi, si colloca sopra una fonte di calore e si attende l’ebollizione. A questo punto si procede al rapido raffreddamento del preparato per evitare che bruci troppo lasciandolo cadere con delicatezza su di una superficie liscia e fredda (marmo, tavolo, pavimento). A questo punto si può osservare direttamente, o meglio si colloca una goccia di Cloralio idrato o L4 appoggiata ad un lato del coprioggetto mentre dal lato opposto si appoggia della carta assorbente. Se necessario aggiungere ancora Cloralio idrato. La carta assorbente attirerà verso di sé il Blu lattico mentre il Cloralio idrato ne prenderà il posto.
- 3. Si riscaldano le fettine immerse nel Blu lattico direttamente sul vetrino ma senza coprioggetto, tenendo sempre il vetrino con una pinzetta, come spiegato al punto 2., ponendolo su una fonte di calore fino all’ebollizione. Aggiungere una goccia di Blu lattico fresco ed asciugare. Aggiungere ora il Cloralio idrato o L4, coprire con il copri oggetto e passare all’osservazione.
E’ già stato detto che se le spore o le ife appaiono incolori sono acianofile, come pure se a colorarsi è il plasma ma non la parete, questo può trarre in inganno, bisogna quindi procedere all’osservazione a 100X con immersione in olio e sfochettare lentamente per capire quale parte della cellula sia interessata dalla reazione. Per avere un termine di paragone conviene sempre avere la possibilità di una contro-reazione, esaminando sia una specie dichiaratamente cianofila che una acianofila.
Molto evidente l’acianofilia nelle spore di Amanita, che costituiscono quindi un ottimo esempio e termine di paragone.
In spore fortemente pigmentate (Agaricus, Psathyrella, ecc.), per evidenti motivi, non è possibile verificare tale reazione.
Singer nei suoi studi afferma che quegli Agaricales delle Famiglie di Agaricaceae, Cortinariaceae, Rhodophyllaceae, Paxillaceae, Gomphidiaceae, Boletaceae, in cui il colore delle spore mature non inibisce l’osservazione dell’assorbimento del Blu cotone, hanno generalmente spore da leggermente a fortemente cianofile, mentre il gruppo di Agaricales con spore più o meno pallide (Amanitaceae, Hygrophoraceae, Polyporaceae s.s.) presentano spore acianofile.
Nelle Tricholomataceae e Russulaceae lo strato esterno amiloide delle spore e la parete di spore pseudoamiloidi sono generalemente acianofile, mentre altre Tricholomataceae hanno parete sporale o ornamentazioni più o meno cianofile: Crinipellis, Chaetocalathus, Lepista, Macrocystidia, Oudemansiella, Armillariella, Fayodia, Laccaria.
Hanno spore cianofile la maggior parte delle Clitocybe con polvere sporale rosa, come pure Pluteus e Volvariella, Cystolepiota, parte delle Tephrocybe, Boletus, Lepiota, Entoloma, Hygrophoropsis, Lyophyllum, Calocybe, Asterophora.
Riferimenti bibliografici:
- 1. Alessandro Francolini “Enciclopedia Micologica” A.M.I.N.T..
- 2. M. T. Basso “Manuale di Microscopia dei Funghi”, Libreria Mykoflora – Alassio, p. 72-76.
- 3. S. Ruini, M. Mariotto, G. Marasca, G. Visentin, G. Michilin “Schede Tecniche di Microscopia
- Micologica”, Centro Studi Micologici – Associazione Micologica Bresadola.
METACROMASIA (Reattivo di Melzer)
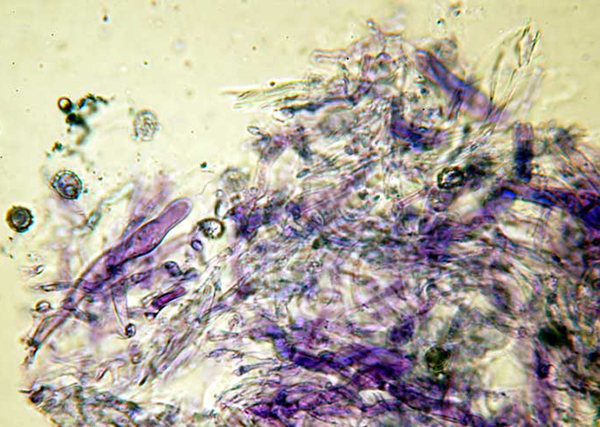
Russula xerampelina: Pileocistidi metacromatici in blu di cresile
Con questo termine s’intende la capacità che hanno alcuni tessuti di assumere una tonalità diversa da quella che ha il colorante.
Tale nome fu coniato nel 1877 non da un micologo ma dal microbiologo tedesco e padre della chemioterapia Paul Herlich.
Si deve a Robert Kϋhner, micologo francese, l’applicazione di questo fenomeno chimico fisico alla micologia, il quale lo evidenziò per la prima volta nel 1927 in Mycena tenerrima e, successivamente, nel 1934 lo estese ad altri Generi e specie di Basidiomiceti. Egli per la verifica della metacromasia su ife, spore e cistidi utilizzò il Blu di cresile (un colorante in polvere basico, blu scuro).
Rolf Singer, botanico e micologo tedesco, nel 1986 ha utilizzato, con buoni risultati, per la reazione metacromatica anche il Blu di toluidina, preferito al Blu di cresile da alcuni micologi nell’indagine sugli Ascomiceti.
La presenza o meno di metacromasia in alcune strutture microscopiche (spore, ife, cistidi) è utile, ad esempio, per distinguere tra loro alcuni Generi all’interno della Famiglia delle Lepiotaceae: metacromatiche sono le spore dei Generi Macrolepiota, Leucoagaricus, Leucocoprinus e Sericeomyces; non metacromatiche, ma amiloidi, inamiloidi o destrinoidi quelle dei Generi Lepiota, Cystolepiota e Chamaemyces.
Spore metacromatiche si trovano anche nel Genere Haasiella.
Molte specie appartenenti ai Generi Mycena, Agrocybe, Lepiota, Hebeloma, Hygrophorus presentano metacromasia nelle ife.
Alcune Sezioni nel Genere Mycena si possono separare per avere le ife metacromatiche, ad esempio la reazione è positiva e ben evidente nella Sezione Amabilissimae e Floccipedes (++++), solo molto debolmente positiva in Aciculae e Hiemales (+), negativa nelle Lactae e Mycenella.
Nel Genere Crinipellis i peli della cuticola sono metacromatici, mentre non c’è metacromasia nel vicino Genere Marasmius.
Le pareti dei cistidi di Melanoleuca, i basidi dei Tricholoma e le ornamentazioni di alcune specie di Russula sono altri esempi di strutture metacromatiche.
Vengono definiti ortocromatici tutti quegli elementi che assumono la stessa tonalità del colorante, nel caso del Blu di cresile le strutture in causa diventeranno di colore blu. Metacromatici sono quelle strutture che diventano di un colore diverso da quella di partenza, nel caso del Blu di cresile gli elementi diventano rossi o porpora.
Preparazione del Blu di cresile
Soluzione acquosa satura:
versare in una beuta 50 mL di acqua distillata e, successivamente, tanta polvere di Blu di cresile agitando, sino a quando lo stesso colorante non si scioglie più rimanendo come corpo di fondo. Quindi filtrare. La soluzione satura è pronta e va preparata al momento dell’uso.
Soluzione secondo Clemençon:
Blu di cresile: 0,25 g; Invadin: 0,5 g; Glicerina F.U.: 17 mL; Alcool etilico al 70%: 27 mL; acqua distillata: 55,5 mL.
Mescolare i vari composti secondo l’ordine indicato nella formulazione e filtrare dopo un giorno.
La preparazione secondo Clemençon è molto stabile.
Preparazione del Blu di toluidina (in sostituzione del Blu di cresile)
Soluzione acquosa all’1%:
sciogliere 0,5 g di colorante in 49,5 mL di acqua distillata.
Soluzione secondo Clemençon:
Blu di toluidina: 200 mg; Glicerina F.U. 21,4 g; Alcool etilico 96°: 27 mL; acqua distillata: 55 mL.
Sciogliere nell’ordine indicato i vari componenti.

Esecuzione
Per questa metodica si può procedere in due modi, si sceglierà quale utilizzare in base all’elemento che si deve osservare:
- per l’osservazione di ife e cistidi si potrà utilizzare il metodo diretto che prevede la semplice colorazione;
- nel caso di spore è preferibile il metodo ammonio-acetico poiché rigonfiando la parete sporale si rende più evidente la reazione metacromatica.
Metodo diretto
1. Si procede a fare delle sottili fettine che si collocano sul vetrino, si depone vicino una
goccia di Blu di cresile o di Blu di toluidina e vi si fanno scivolare le fettine.
2. Si lascia agire per 4-5 minuti, poi se il preparato è troppo scuro si assorbe il colorante con della carta da filtro e si colloca al suo posto una goccia di acqua distillata, diversamente si
mette il coprioggetto e si passa direttamente all’osservazione.
Metodo ammonio-acetico di Locquin
1. Si fanno delle sottili fettine che si collocano sul vetrino, si versa una goccia di idrossido di
ammonio (NH4OH al 2-3%) e vi si fanno scivolare le fettine.
2. Si lascia agire per 5 minuti, poi si asciuga con della carta assorbente, si aggiunge una
goccia di Acido acetico (volendo si può procedere senza l’immersione in Acido acetico).
3. Si asciuga ancora e si aggiunge una goccia di Blu di cresile o di Blu di toluidina, si colloca
sopra il coprioggetto e si passa all’osservazione.
Riferimenti bibliografici:
1. M. T. Basso “Manuale di Microscopia dei Funghi”, Libreria Mykoflora – Alassio, p. 70-72.
2. S. Ruini, M. Mariotto, G. Marasca, G. Visentin, G. Michilin “Schede Tecniche di Microscopia
Micologica”, Centro Studi Micologici – Associazione Micologica Bresadola.

AMILOIDIA (Reattivo di Melzer)
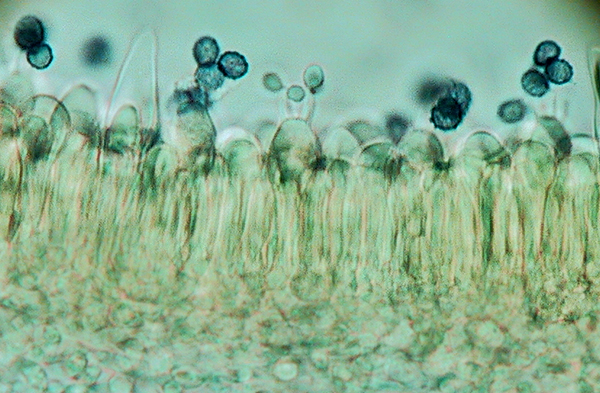 Spore di Russula peckii
Spore di Russula peckii
Si indica con questo termine una reazione fra lo iodio e l’amido presente in alcune strutture fungine, l’amido assume in presenza dello iodio un colore azzurro scuro fino a nerastro.
L’amido si comporta come un’indicatore, infatti complessa lo iodio in soluzione secondo la reazione:
![]()
Il reattivo prende il nome del micologo boemo Vaclav MELZER (1878-1968) che perfezionò, nel 1924, la procedura per verificare o meno l’amiloidia di certe componenti fungine. Melzer, modificò un precedente preparato chimico [del medico francese Jean Guillaume Auguste LUGOL (1786-1851) che ne aveva suggerito l’impiego nel trattamento della tubercolosi].
Inizialmente impiegata nello studio dell’amiloidia delle spore del Genere Russula, tale reazione sarà in seguito adottata nello studio dell’amiloidia per molti altri Basidiomiceti e Ascomiceti (e non soltanto riguardo alle spore), contribuendo a migliorare la ricerca tassonomica.
La ricetta “originale” del 1924 del reattivo di Melzer è la seguente:
Soluzione madre (o soluzione iodo-iodurata):
- KI ………………… 1,5 g;
- I2 …………………. 0,5 g;
- H2O dist. ………. 20 mL.
Per la preparazione della soluzione madre, occorre tener presente che lo iodio è scarsamente solubile in acqua ma solubile nelle soluzioni iodurate.
A tal proposito si scioglie per primo lo ioduro di potassio in 15 mL di acqua, si aggiunge quindi lo iodio fino a completa dissoluzione (questa operazione è piuttosto lunga), completare con la rimanente acqua distillata, agitare ancora (verificare mediante decantazione in quanto la soluzione è molto scura e non permette di vedere l’eventuale presenza di materiale indisciolto). A questo punto la soluzione madre è pronta.
Reattivo di Melzer:
- Soluzione madre ……………………. 5 mL;
- Cloralio idrato in cristalli …………. 5 g.
Mettere la soluzione madre e il Cloralio idrato in un flacone, agitare fino a completa dissoluzione.
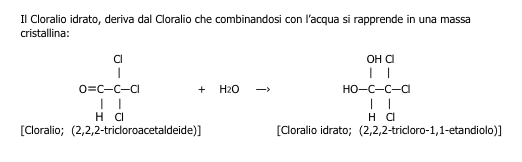
Il Cloralio idrato, deriva dal Cloralio che combinandosi con l’acqua si rapprende in una massa cristallina:
- Si parla di reazione amiloide positiva quando il reattivo (che di per sé ha un colore rosso-giallognolo) colora i tessuti (in particolare la parete sporale, gli aschi, ecc.) con tonalità dal grigio al grigio-blu fino al blu scuro.
- La reazione viene definita pseudo amiloide o destrinoide, quando i tessuti si colorano di bruno-rossastro o di color tabacco fino a color porpora.
- La reazione si definisce inamiloide o nulla quando i tessuti assumono il colore naturale del reattivo, cioè bruno-giallognolo.
A seconda delle specie l’amiloidia può coinvolgere tutta la parete della spora o solo le ornamentazioni (aculei, verruche, creste), mentre qualche volta lo sono anche altre parti del fungo (ife, trama).
Basidiomiceti:
Le spore del Sottogenere Lepidella del Genere Amanita (A. phalloides, A. verna, A. citrina, A. rubescens, A. strobiliformis, A. spissa); le spore del Genere Melanoleuca, Leucopaxillus, Lactarius, Russula, Lentinellus con ornamentazione amiloide, e, inoltre, le spore di generi poco noti quali Catathelasma, Delicatula, Panellus, Porpoloma, Strobilurus.
Si hanno spore amiloidi non solo tra le Agaricaceae, ma anche tra gli Aphyllophorales, ad esempio Aleurodiscus (Cortciaceae), Hericium (Hericiaceae), Bondarzewia (Bondarzewiaceae).
Le ife alla base del gambo di Chroogomphus reagiscono in nero-blu; sono inoltre amiloidi le ife della pellicola pileica di certi Boletus e la trama di alcuni Albatrellus.
Ascomiceti:
Nella famiglia delle Pezizaceae (Discomiceti) è importante, per la delimitazione del genere, osservare se l’apice dell’asco si colora o meno in blu.
Diviene blu nei generi Peziza, Pachyella (l’asco diviene blu interamente e non solo l’apice), Plicaria, Sarchosphaera, Otidea, Tarzetta non danno questa reazione.
Ciò vale anche nella famiglia delle Ascobolaceae: divengono blu gli aschi di Boudiera, Iodophanus, Thecotheus, Ascobolus e Saccobolus. Non così in Pyronema, Coprotus, Ascodemis e Fimaria. Anche negli inopercolati l’amilodia dell’apice dell’asco ha importanza. In questo caso però non si usa più l’espressione amiloide o inamilaoide ma si definiscono pori iodopositivi (J+) e iodonegativi (J–).
Ma la reazione non serve solo per la tassonomia, anche in tossicologia questa appare particolarmente importante, le specie di Amanita mortali hanno spore amiloidi e l’individuarle nei succhi gastrici o negli avanzi del pasto può significare salvare la vita ad una persona, in quanto si può intervenire tempestivamente con i trattamenti terapeutici del caso.
Come è già stato detto, per reazione pseudoamiloide o destrinoide si intende la reazione bruna, rosso bruna fino a porpora, delle spore, ife, ecc. con il reattivo di Melzer.
Così per esempio le spore incolori, bianche in massa, di specie di Macrolepiota, Leucoagaricus, Lepiota, Chaetocalathus, Leucocoprinus, ecc., si colorano col Melzer in rosso-bruno cupo e così pure quelle di Hygrophoropsis aurantiaca. Qualche volta anche altre parti del fungo danno questa reazione, per esempio ife (Pseudobaeospora, Hydropus), metuloidi (Geopetalum), trama di diverse Mycena, Marasmius, ecc., peli di Discomiceti e di Basidiomiceti.
Note:
Se si lavora su materiale secco far rinvenire il reperto in ammoniaca o altro reidratante, non usare KOH per il rigonfiamento dei tessuti che devono essere poi trattati con il Melzer, i risultati potrebbero essere notevolmente alterati.
Il reagente di Melzer si conserva per un periodo variabile dai 6 mesi a 1 anno e più a condizione che sia conservato ben chiuso, al riparo da aria e luce. CHARBONELL (2004) suggerisce di conservare la soluzione madre che ha una durata più lunga, oltre 10 anni, e separatamente i cristalli di Cloralio idrato, e preparare piccole dosi del reattivo di Melzer.
Esempi di spore amiloidi:
- Albatrellus
- Amanita (parte)
- Armillaria Lactarius
- Lentinellus
- Melanoleuca
- Mycena (parte)
- Panellus
- Russula
- Xeromphalina
Esempi di ife amiloidi:
- Albatrellus confluens
- Boletus (alcuni)
- Chroogomphus
- Rozites caperatus
Esempi di spore destrinoidi o pseudoamiloidi:
- Collybia (parte)
- Galerina
- Lepiota
- Lepista
- Leucocoprinus
- Limacella (parte)
- Macrolepiota
- Pseudobaespora
Esempi di ife pseudoamiloidi:
- Hydropus
- Marasmius (trama)
- Mycena (trama)
- Pseudobaespora
Come procedere per l’osservazione:
Con il reattivo di Melzer: poniamo dei piccoli frammenti o fettine sul vetrino, mettiamo a fianco una goccia del reagente di Melzer facendola scivolare con un ago sulle fettine; attendere 1-2 minuti, coprire con il coprioggeto, asciugare l’eccedenza ed osservare.
Con la soluzione madre: poniamo dei piccoli frammenti o fettine sul vetrino, mettiamo a fianco una goccia di soluzione madre facendola scivolare con un ago sulle fettine, uniamo pochi cristalli di Cloralio idrato, mescoliamo con un ago affinché il Cloralio idrato si sciolga, attendere 1-2 minuti, coprire con il copri oggetto, asciugare l’eccedenza ed osservare.
Riferimenti bibliografici:
1. Alessandro Francolini “Enciclopedia Micologica” A.M.I.N.T..
2. M. T. Basso “Manuale di Microscopia dei Funghi”, Libreria Mykoflora, Alassio, p. 63-65.
3. S. Ruini, M. Mariotto, G. Marasca, G. Visentin, G. Michilin “Schede Tecniche di Microscopia
Micologica”, Centro Studi Micologici – Associazione Micologica Bresadola.

Macroreagenti: preparazione di soluzioni diluite da soluzioni concentrate
di Gianni Crocè
Prima di affrontare questo argomento è opportuno sapere cosa s’intende per concentrazione di una soluzione ed i modi più frequentemente usati per esprimerla: la concentrazione di una soluzione è la quantità di soluto (massa o volume) presente in una precisa quantità di solvente (quasi sempre acqua distillata) o di soluzione.
ALCUNE UNITA’ DI MISURA DELLA CONCENTRAZIONE
▪ percento in peso (% m/m) grammi di soluto in 100 g di soluzione
• percento in volume (% v/v) millilitri di soluto in 100 ml di soluzione
• percento in peso su volume (% p/v o m/v) grammi di soluto in 100 ml di soluzione
Per preparare una soluzione ad una determinata concentrazione si opera in modo diverso a seconda che si parta da una sostanza solida più o meno pura (preparazione per pesata) oppure da una soluzione (preparazione per diluizione).
Nella preparazione per pesata, il soluto viene pesato e sciolto nella minima quantità di solvente, indi viene trasferito in un contenitore (generalmente un matraccio) e viene portato al volume desiderato.
Nella preparazione per diluizione, si preleva un determinato volume di soluzione concentrata e vi si aggiunge la quantità opportuna di solvente.
Idrossido di potassio (KOH) al 30%
Si debbano preparare 46 g una soluzione di KOH al 30% in peso (cioè m/m), disponendo di KOH solida all’85% in peso (cioè non completamente pura).
Basta applicare la seguente formula: (a ▪ x) + (b ▪ y) = (a+b)z
dove:
a = g di KOH solida;
x = concentrazione KOH solida;
b = g solvente (acqua distillata);
y = concentrazione solvente (per H2O = 0);
z = concentrazione KOH finale.
(a ▪ 85) + (b ▪ 0) = 46 ▪ 30; 85a = 1380; a = 16 g di KOH all’85%
b = 46 – 16 = 30 g (cioè ml) di H2O dist.
Per chi è abituato all’uso delle proporzioni:
30 : 100 = x :46; x = 13,8 g di KOH se fosse pura al 100%
dispondendo di potassa all’85% avremo bisogno di:
13,8 : 85 = y : 100; y = 16g di KOH all’85%
Preparazione:
In un vetrino da orologio si pesano esattamente 16g di KOH solida (per prelevare la potassa, usare una spatola).
In un becker da 50cc si versano 30ml di acqua distillata, quindi 16g di KOH; si agita con una bacchetta di vetro sino a completa dissoluzione, facendo attenzione in quanto la reazione è esotermica (sviluppa calore).
Acido Solforico (H2SO4) al 72 (% m/m)
Si debbano preparare, ad esempio, 30 ml di H2SO4 al 72 (% m/m) disponendo di una soluzione di H2SO4 al 96 (% m/m), d = 1, 84 g/l.
(a ▪ x) + (b ▪ y) = (a+b)z
dove:
a = ml H2SO4 iniziali;
x = concentrazione H2SO4 iniziale;
b = ml solvente (acqua distillata);
y = concentrazione solvente (per H2O = 0);
z = concentrazione H2SO4 finale.
(a ▪ 96) + (b ▪ 0) = 50 ▪ 72; 96a = 2160; a = 22,5 ml H2SO4 al 96%
b = 30 – 22,5 = 7,5 ml H2O distillata
Qualora volessimo sapere i g di H2SO4 al 96%, bisogna considerare la sua densità:
d slz = g slz/V slz; g slz = d slz ▪ V slz = 1,84 ▪ 22,5 = 41,4 g H2SO4 al 96%
Idrossido di ammonio (NH4OH) al 25% m/m
Determinare quanti ml di NH4OH al 25% m/m (d = 0,910 g/l) sono necessari per preparare 300 g di soluzione ammoniacale al 5% m/m.
(a • x) + (b • y) = (a + b)z;
a = g NH4OH iniziali;
x = concentrazione NH4OH iniziale;
b = g solvente (H2O);
y = concentrazione solvente (per H2O = 0);
z = concentrazione NH4OH finale.
(a • 25) + (b • 0) = 300 • 5; 25a = 1500; a = 60 g di NH4OH al 25%
b = 300 – 60 = 240 g (cioè ml) di H2O dist.
dslz = gslz/Vslz; Vslz = gslz/dslz = 60/0,910 = 65,9 ml di NH4OH al 25%
In pratica si prelevano 65,9 ml di NH4OH al 25% e si miscelano con 240 ml di H2O dist..
Quanti g di NaOH solida al 97% sono necessari per preparare 30 g di una soluzione di NaOH al 5%?
(a • x) + (b • y) = (a + b) z;
(a • 97) + (b • 0) = 30 • 5; 97a = 150; a = 1,55 g di NaOH al 97%
b = 30 – 1,55 = 28,45 g di H2O dist.
Per chi è abituato all’uso delle proporzioni:
5 : 97 = x : 30; x = 1,55 g di NaOH al 97%
In pratica si pesano 1,55 g di NaOH al 97% e si solubilizzano in 28,45 ml di H2O dist..
Solfato di ferro (FeSO4) al 10%
Il solfato di ferro in soluzione acquosa, normalmente al 10%, è uno dei reagenti che trova larghissimo impiego in tutta l’area degli imenomiceti agaricoidi.
Circa la sua preparazione, potrebbero sorgere dei problemi quando non si dispone di FeSO4 puro al 100%.
Esempio•
Si debbano preparare 40 g una soluzione di FeSO4 al 10% in peso (cioè m/m), disponendo di FeSO4 all’85% in peso (cioè non completamente puro).
Basta applicare la seguente formula: (a ▪ x) + (b ▪ y) = (a+b)z
dove:
a = g di FeSO4 solido;
x = concentrazione FeSO4 solido;
b = g solvente (acqua distillata);
y = concentrazione solvente (per H2O = 0);
z = concentrazione FeSO4 finale.
(a ▪ 85) + (b ▪ 0) = 40 ▪ 10; 85a = 400; a = 4,7 g di FeSO4 all’85%
b = 40 – 4,7 = 35,3 g (cioè ml) di H2O dist.
Per chi è abituato all’uso delle proporzioni:
10 : 100 = x :40; x = 4 g di FeSO4 se fosse pura al 100%
dispondendo di solfato ferroso all’85% avremo bisogno di:
4 : 85 = y : 100; y = 4,7 g di FeSO4 all’85%
Preparazione:
In un beker da 50 cc, precedentemente pesato, si aggiungono esattamente 4,7 g di FeSO4 solido (per prelevare il solfato ferroso usare una spatola). Si versano nel contenitore e si aggiungono 35,3 ml di H2O distillata, si agita con una bacchetta di vetro sino a completa dissoluzione
NORME DI SICUREZZA
Quando si devono preparare soluzioni diluite, partendo da soluzioni di acidi o basi concentrate, è necessario versare la soluzione acida o basica in acqua e mai viceversa (questo si rende necessario al fine di evitare violenti spruzzi che potrebbero provocare gravi lesioni cutanee). In ogni caso è sempre meglio fare queste operazioni utilizzando degli occhiali protettivi e lavorando sotto cappa.
Funghi d’Aspromonte non si ritiene responsabile di eventuali errori od incidenti che dovessero capitare a chiunque si accinga a lavorare con prodotti chimici potenzialmente pericolosi.

